Rabu, 21 Juni 2023
Home »
hepatitis. 1
» hepatitis 1
hepatitis 1
Juni 21, 2023
hepatitis. 1
Penyakit hati disebabkan oleh berbagai macam sebab, namun
secara klinis diklasifikasikan menjadi:
1. Hepatoseluler, gambaran klinis penyakit hepatoseluler predominan
kerusakan hati, inflamasi, dan nekrosis.
2. Kolestatik , gambaran klinis predominan hambatan aliran empedu.
Evaluasi pasien dilakukan untuk menentukan diagnosis etiologi,
berat ringannya penyakit, dan tingkatan penyakit. Diagnosis difokuskan
untuk membedakan antara hepatoseluler dan kolestatik. Pada
penentuan beratnya penyakit, selain dibedakan penyakit hati ringan,
sedang, dan berat juga menentukan aktif atau inaktif. Sedangkan untuk
penentuan tingkatan penyakit dibedakan menjadi akut atau kronik,
stadium awal atau lanjut, presirosis, sirosis, atau fase akhir (end-stage).
I.1.1. GEJALA DAN TANDA
Beberapa gejala penyakit hati adalah ikterus, kelelahan, gatal,
nyeri perut kanan atas, kembung, epigastrium discomfort, dan pada
keadaaan yang berat dapat disertai perdarahan intestinal. Beberapa
pasien tidak memiliki gejala penyakit ini namun ditemukan hasil
pemeriksaan biokimia hati abnormal.
Ikterus
Ikterus adalah warna kuning pada kulit, sclera, dan membrane
mukosa karena akumulasi berlebihan dari pigmen bilirubin. Kadar
bilirubin total serum lebih dari 3 mg/dL
Hiperbilirubinemia dapat dibedakan menjadi peningkatan
unconjugated bilirubin dan conjugated bilirubin. Peningkatan
unconjugated bilirubin disebabkan oleh produksinya yang berlebihan
(hemolitik atau eritropoeisis inefektif), gangguan ambilan (uptake) oleh
hati. atau gangguan conjugasi bilirubin (obat atau kelainan genetic).
Peningkatan conjugated bilirubin disebabkan oleh penurunan ekskresi
ke dalam saluran empedu pada penyakit hati atau kelainan genetik
tertentu. Untuk evaluasi pasien dengan ikterus maka perlu dilakukan
pemeriksaan laboratorium untuk menentukan diagnosis penyakitnya
(Gambar I.1)
Kelelahan
Kelelahan merupakan gejala yang sering terjadi pada penyakit
hati.Kelelahan tipe penyakit hati adalah kelelahan yang timbul setelah
aktivitas atau olah raga namun jarang ada pada pagi hari setelah
istirahat yang cukup.
Mual
Mual diprovokasi oleh bau makanan atau makan makanan yang
berlemak atau disertai dengan kelelahan.Muntah terjadi namun jarang
menetap.Nafsu makan rendah disertai penurunan berat badan sering
terjadi pada penyakit hati akut namun jarang terjadi pada penyakit
kronik kecuali bila penyakit hati kronik berkembang menjadi sirosis.
Diare jarang terjadi, kecuali ikterus berat dimana tidak adanya asam
empedu yang mencapai usus (intestinal) sehingga menyebabkan
steatore.
Rasa tidak nyaman dan nyeri di abdomen region kanan atas
Nyeri ini timbul karena penekanan atau iritasi kapsul Glisson yang
mengelilingi hati dan kaya akhiran saraf (nerve endings).Gejala ini
biasanya ditandai dengan nyeri tekan di sekitar area hati.
1.2. PEMERIKSAAN BIOKIMIA HATI
Untuk menegakkan diagnosis penyakit hati dilakukan beberapa
pemeriksaan biokimia hati. Pemeriksaan ini juga menentukan tipe
penyakit hati yaitu penyakit hepatoseluler atau kolestatik. Pemeriksaan
fungsi hati meliputi pemeriksaan fungsi ekresi, fungsi sintesis, fungsi
integritas sel hati dan fungsi aliran empedu.3
Test fungsi ekskresi dan detoksifikasi hati antara lain
pemeriksaan bilirubin serum dan amoniak darah. Fungsi integritas sel
hati adalah pemeriksaan enzim transaminase Alanin aminotransferase
(ALT) dan Aspartat aminotransferase (AST). Pemeriksaan fungsi
biosintesis hati adalah pemeriksaan kadar albumin serum, aktivitas
cholinesterase, dan nilai Protrombin Time (PT). Untuk mengevaluasi
aliran empedu atau menilai ada tidaknya kolestasis dengan pemeriksaan
aktivitas Gamma Glutamyl Transferase (GGT), Alkali phosphatase (ALP),
Acid phosphatase, dan 5’nucleotidase.
I.1.2. Bilirubin
Bilirubin merupakan anion organik hasil katabolisme hemoglobin.
Kadar normal dalam serum < 1 mg/dL. Ikterus terjadi bila kadarnya
dalam darah > 3 mg/dL.Bila terjadi peningkatan kadarnya dalam serum
perlu juga ditentukan jenis bilirubin yang meningkat. Bilirubin ini
merupakan penanda fungsi eksresi hati.
Peningkatan kadar bilirubin dalam serum terjadi pada keadaan
peningkatan produksi, menurun ambilan (uptake) oleh hati, penurunan
konjugasi di hati, dan penurunan sekresi atau hambatan di saluran
empedu.3,6
Bilirubin juga dapat diperiksa dalam urin. Bilirubin urin
merupakan indikasi penyakit hepatobiliar karena bilirubin unconjugated
terikat oleh albumin sehingga tidak dapat melewati filtrasi di
glomerulus dan tidak akan terdapat dalam urin.
I.1.3. Petanda Penyakit Hati Tipe Hepatoseluler
Pemeriksaan biokimia yang mencerminkan adanya kerusakan
atau nekrosis hepatosit antara lain aminotransferase (ALT dan AST) dan
Laktat Dehidrogenase.4 Ketiga enzim ini terdapat dalam sitosol
hepatosit sehingga bila terdapat kerusakan sel akan terjadi peningkatan
dalam plasma secara cepat. Selain di hepatosit, enzim-enzim tersebut
juga dapat ditemukan di sel lain.
I.1.3.1. Aminotransferase
Enzim ini terdiri dari Alanin Aminotransferase (ALT) dan Aspartat
Aminotransferase (AST). Aktivitasnya adalah katalisator pemindahan
gugus aminodari asam amino alanin atau aspartat menjadi asam
ketoglutarat dan menghasilkan asam oksaloasetat dan asam piruvat
pada proses glukoneogenesis. Pemeriksaan aktivitas enzim ini berfungsi
menilai integritas hepatosit.
Enzim ALT dan AST terdapat dalam sitoplasma dan mitokondria
hepatosit tetapi kadar ALT di mitokondrial relatif sedikit dan waktu
paruhnya sangat pendek sehingga tidak mempunyai nilai diagnosis
sebaliknya AST dalam mitokondria jumlahnya relatif banyak dan
merupakan fraksi terbesar AST di hepatosit. Peningkatan kadar kedua
enzim ini dalam serum merupakan hasil kebocoran dari sel yang rusak
sehingga mencerminkan kerusakan hepatosit.
Selain di hati, ALT juga terdapat di ginjal sedangkan AST
ditemukan di otot lurik, otot jantung, ginjal, otak, pankreas, dan sel
darah.
Ratio AST/ALT dapat digunakan untuk diagnosis banding. Ratio
ini pada kerusakan hati akut < 1 sedangkan pada hepatitis alkoholik,
hepatitis kronik, dan sirosis ratio AST/ALT > 1. Namun hal ini tetap
harus memperhatikan keadaan klinis pasien.6
Peningkatan sedang aminotransferase serum< 500 U/L
ditemukan pada berbagai macam penyakit hati. Pada hepatitis alkoholik
atau obstruksi biliari tanpa kelainan lain maka peningkatannya < 300
U/L, peningkatan tinggi dan sementara terjadi setelah obstruksi biliari
akut, virus dan hepatitis terinduksi asetaminofen peningkatan > 1000
U/L. Namun tidak terdapat korelasi antaara besarnya peningkatan
aminotransferase dengan luasnya nekrosis hepatosit.
I.1.3.2. Laktat Dehidrogenase
Enzim terdapat di berbagai jaringan seperti pada otot serat
lintang, otot jantung, membran eritrosit, ginjal, dan hati. Peningkatan
LDH tidak spesifik untuk penyakit hati namun bermanfaat untuk
I.1.4. PETANDA PENYAKIT HATI TIPE KOLESTASIS
I.1.4.1. ALKALI PHOSPHATASE
Enzim ALP terdapat pada beberapa jaringan antara lain hati,
tulang, usus, ginjal, plasenta, leukosit, dan sel neoplasma. Bila terjadi
peningkatan metabolisme maka ALP cenderung meningkat. Aktivitas
ALP pada orang dewasa muda lebih tinggi 3 kali lipat dibandingkan
dewasa karena kecepatan pertumbuhan tulang. ALP meningkat pada
keadaan:
1. Akhir kehamilan akibat pertumbuhan plasenta dan metabolisme
2. Gagal ginjal kronik
3. Kelainan genetik tanpa penyakit hati
4. Penyakit hati karena peningkatan sintesis, pengeluaran enzim ke
dalam serum, dan gangguan sekresi biliar
Peningkatan ALP pada Penyakit Hati
Enzim ALP hati terdapat di permukaan domain apikal
(contohnya kanalikular) dari membran plasma hepatosit dan dalam
domain lumen dari epitel saluran empedu. Peningkatan ALP pada
penyakit hati merupakan hasil peningkatan sintesis dan pelepasan
enzim ke dalam serum dibandingkan gangguan sekresi biliar. Asam
empedu yang tertahan pada penyakit hati tipe kolestatik akan
melarutkan membran plasma hepatosit dan menyebabkan keluarnya
ALP. Namun peningkatan ALP tidak terjadi dalam 1-2 hari setelah
obstruksi biliar akut karena untuk peningkatan ALP dalam serum
membutuhkan sintesis enzim baru. Waktu paruh ALP 1 minggu sehingga
setelah terjadi resolusi obstruksi biliar ALP akan tetap tinggi selama
beberapa hari. Peningkatan ALP pada infiltrasi di hati disebabkan
karena penekanan beberapa saluran empedu kecil intrahepatik.
Walaupun terjadi peningkatan ALP karena obstruksi saluran
intrahepatik fokal namun kadar bilirubin serum normal. Besarnya kadar
ALP tidak dapat digunakan untuk membedakan antara obstruksi saluran
intrahepatik atau ekstrahepatik. Interpretasi peningkatan ALP pada
penyakit hati:
1. Peningkatan aktivitasnya kurang sama dengan 3X nilai rujukan
relatif tidak mencerminkan penyebab spesifik dan dapat terjadi
pada beberapa penyakit hati
2. Peningkatan tajam ALP predominan kelainan hepatik infiltratif
(seperti tumor baik primer atau metastasis) atau obstruksi biliar
baik intrahepatik (seperti pada sirosis biliar primer) maupun
ekstrahepatik.
I.1.4.2. Gamma Glutamyl Transpeptidase
Enzim GGT hepatik berasal dari hepatosit dan epitel biliar. Selain
di hati, GGT juga dapat ditemukan di beberapa jaringan ekstrahepatik
seperti ginjal, lien, pankreas, jantung, paru, dan otak. Tetapi GGT tidak
ditemukan di tulang sehingga dapat digunakan untuk konfirmasi asal
peningkatan ALP. Kadar GGT infant lebih tinggi dibandingkan orang
dewasa. Interpretasi nilai GGT adalah:
1. Peningkatan 5-30 kali nilai rujukan terdapat pada obstruksi biliar
posthepatik dan intra hepatik, serta keganasan hepar baik primer
maupun sekunder.
2. Peningkatan moderat 2-5 kali nilai rujukan kemungkinan
disebabkan oleh hepatitis infeksi.
3. Peningkatan 5-15 kali nilai rujukan dapat dijumpai pada pankreatitis
akut maupun kronik serta keganasan pankreas yang berhubungan
dengan obstruksi hepatobiliar
4. Peningkatan ringan terdapat pada perlemakan hati (fatty liver)dan
intoksikasi obat.
Nukleotidase
Enzim ini ditemukan di berbagai jaringan seperti hati, otot
jantung, otak, pembuluh darah, dan pankreas. Peningkatannya yang
signifikan hanya terjadi pada penyakit hati. 5’NT hepatik terdapat
dalam sinusoid hepatosit dan membran plasma kanalikuler. Kadarnya
meningkat beberapa hari setelah obstruksi akut sehingga tidak dapat
dijadikan konfirmasi peningkatan kadar ALP serum.
I.1.5. Pemeriksaan Fungsi Sintesis Hati
I.1.5.1. Prothrombin Time
Hati berperan dalam mekanisme hemostasis karena sebagian
besar faktor koagulasi disintesis oleh hepatosit, kecuali F.VIII yang
dibuat di endotel vaskuler dan sel retikuloendotelial. Bila terjadi
gangguan sintesis pada penyakit hati akan terjadi pemanjangan nilai PT.
Selain penyakit hati PT memanjang pada defisiensi vitamin K, DIC,
pemberian warfarin, dan defisiensi kongenital faktor koagulasi. Untuk
membedakan pemanjangan PT akibat defisiensi vitamin K atau
gangguan sintesis hati dapat dilakukan uji vitamin K dengan
menyuntikkan vitamin K kemudian diperiksa kembali PT. Bila PT
kembali normal berarti disebabkan oleh defisiensi vitamin K namun jika
tetap memanjang berarti terjadi gangguan sintesis hati. Sedangkan
untuk membedakan dengan DIC dilakukan pengukuran kadar Faktor
VIII. Kadar F.VIII menurun pada DIC sedangkan pada penyakit hati
normal atau meningkat.
I.1.5.2. Albumin
Sintesis dan sekresi albumin oleh hepatosit berkisar 10 g/hari.
Bila terjadi kerusakan sel parenkim hati akan terjadi penurunan sintesis
albumin sehingga menyebabkan penurunan kadar albumin dalam
serum. Selain faktor hepatik, konsentrasi albumin serum juga
ditentukan oleh berbagai macam faktor ekstrahepatik seperti nutrisi,
integritas vaskuler, katabolisme, hormonal, danekskresinya melalui urin
atau feses. Berdasarkan hal tersebut maka penurunan kadar albumin
tidak spesifik disebabkan oleh kelainan hati.
Waktu paruh albumin sekitar 20 hari sehingga pada penyakit hati
kronis kadarnya dalam serum masih normal. Untuk mengetahui adanya
gangguan sintesis hati pada penyakit hati akut lebih baik digunakan
pemeriksaan PT. Prealbumin juga disintesis oleh hati namun memiliki
waktu paruh lebih singkat sehingga dapat digunakan untuk diagnosis
gangguan fungsi sintesis hati pada gagal hati akut. Namun pengukuran
ini tidak spesifik untuk penyakit hati.4 Ringkasan pemeriksaan pada
gangguan hati dapat dilihat pada tabel dibawah ini.
Pemeriksaan Serologi
Pemeriksaan serologi digunakan untuk diagnosis etiologi penyakit
hati. Pemeriksaan tersebut antara lain adalah:
1. Pemeriksaan serologi infeksi virus hepatitis
a. Virus Hepatitis A, untuk infeksi akut dapat diperiksa IgM anti HAV
sedangkan untuk infeksi kronik dapat diperiksa IgG anti HAV
b. Virus hepatitis B, pemeriksaan yang dilakukan antara lain HBsAg,
anti HbcAg total, IgM anti HBc, HBeAg, anti HBe
c. Virus hepatitis C, pemeriksaan yang dilakukan antara lain anti
HCV total
d. Virus hepatitis D, pemeriksaannya adalah anti HDV
2. Pemeriksaan serologi infeksi virus selain hepatitis seperti CMV,
Rubella, EBV, HSV
3. Pemeriksaan Leptospirosis
4. Pemeriksaan Widal
5. Pemeriksaan untuk hepatitis karena autoimun yaitu pemeriksaan
Anti Nuclear Antibody (ANA) dan anti LKM-1 (Liver Kidney
Microsom-1)
I.3. Pemeriksaan Hematologi
Pemeriksaan hematologi lengkap dapat memberikan gambaran
mengenai penyebab ikterus. Ikterus yang disebabkan oleh proses
hemolitik dapat memberikan gambaran hemolitik pada gambaran darah
tepi. Selain itu juga dapat membantu menegakkan diagnosis infeksi
virus hepatitis akut. Pada hepatitis virus akut biasanya dapat dijumpai
netropenia dan limfositopenia sementara yang kemudian diikuti
limfositosis.
I.4. Pemeriksaan Urinalisa
Urinalisa dapat digunakan untuk menegakkan diagnosis etiologi
ikterus dan penyakit hati terutama dengan menilai kadar bilirubin urin
dan urobilinogen urin. Bila bilirubin urin (-) sedangkan urobilinogen
urin meningkat maka kemungkinan penyebab ikterus adalah hemolitik.
Pada hemolitik terjadi peningkatan produksi bilirubin unconjugated.
Bilirubin ini terikat oleh albumin dan tidak larut dalam air sehingga
tidak dapat melalui filtrasi ginjal dan tidak akan ditemukan di dalam urin
kecuali terdapat kebocoran ginjal. Sedangkan bila bilirubin urin (+) dan
urobilinogen urin meningkat kemungkinan ikterus disebabkan oleh
penyakit hati tipe hepatoseluler. Sebaliknya bila bilirubin urin (+) dan
urobilinogen urin rendah atau (-) kemungkinan disebabkan oleh
penyakit hati tipe kolestastik karena aliran bilirubin conjugated melalui
saluran empedu menuju usus halus terhambat sehingga sedikit bahkan
tidak ada bilirubin yang mencapai usus akibatnya tidak terjadi
pembentukan urobilinogen. Bila urobilinogen tidak terbentuk maka
tidak ada urobilinogen yang masuk sirkulasi enterohepatik yang
selanjutnya akan menuju ginjal dan akan diekskresi melalui ginjal.10
Selain itu dapat pula diperiksa metabolit obat untuk menentukan
etiologi hepatitis akibat terinduksi obat atau intoksikasi alkohol.
Pemeriksaan Mikrobiologi
Pemeriksaan ini penting bila ada indikasi terjadinya abses hati
atau infeksi sistemik yang mempengaruhi hati yang disebabkan oleh
mikroorganisme tertentu. Pada abses hati perlu ditentukan
penyebabnya. Mikroorganisme penyebab abses hati bervariasi. Bila
infeksi berasal dari cabang saluran empedu maka kemungkinan
penyebabnya adalah batang negatif Gram enterik aerob atau
enterococci aerob, bila berasal dari infeksi pelvis atau sumber
intraperitoneal lain kemungkinan disebabkan oleh gabungan kuman
aerob maupun anaerob seperti B.fragilis, sedangkan bila penyebaran
hematogen kemungkinan adalah S. Aureus atau Streptococcal sp
.Penyebab lain adalah Candida sp dan amuba.
Definisi dan Klasifikasi
Hepatitis didefinisikan sebagai proses peradangan pada hati
sehingga menimbulkan kerusakan pada hati. Bila hepatitis berlangsung
<6 bulan maka diklasifikasikan sebagai hepatitis akut.Penyakit hati
diklasifikasikan menjadi penyakit hepatoseluler dan kolestatik
(obstruktif). Gambaran penyakit hepatoseluler (Hepatitis)
1. Gambaran kerusakan hati
2. Inflamasi
3. Nekrosis
Sedangkan gambaran pada kolestasis (obstruksi) adalah hambatan aliran
empedu lebih dominan.
II.2. Etiologi
Hepatitis akut dapat disebabkan oleh berbagai macam hal yaitu:
1. Infeksi hepatosit oleh virus (hepatitis virus, CMV, Rubella, HSV,
EBV), bakteri, parasit, mononukleosis, amoeba
2. Intoksikasi alkohol Alkohol
3. Akibat infeksi sistemik seperti (tuberkulosis, sarkoidosis)
4. Intoksikasi obat (asetaminofen, isoniazid, phenitoin, metotrexate)
atau toksin lainnya
5. Autoimun hepatitis
6. Kelainan metabolik (NAFLD)
7. Obstruksi
8. Genetik (defisiensi AAT, hemokromatosis herediter)
9. Kehamilan
Hepatitis A Akut
II.3.1. Etiologi
Infeksi ini disebabkan oleh virus hepatitis A. Virus ini merupakan
famili picorna virus genus hepatovirus. Morfologi virus hepatitis A :
1. Tidak mempunyai selubung (nonenveloped)
2. Spheris
3. Positive stranded
4. Ukuran 27-32 nm
5. Virionnya mengandung 4 kapsid polipeptida
6. Kapsid-kapsid kosong banyak ditemukan dalam feses selama
masa awal infeksi
7. Genom HAV linear, single stranded, positive-sense RNA 7,5 kb
yang mengandung 5’regio nontranslasi dengan struktuk tersier
dan sekunder kompleks
8. 5’end mencerminkan regio non coding (NCR) yang akan berikatan
secara kovalen dengan protein virus VPg (2,5 kD)
9. Memiliki poliprotein besar single yang diekspresikan sepanjang
RNA genom
10. Poliprotein akan dipecah oleh protease virus membentuk 3
(bahkan 4) protein kapsid dan beberapa protein struktural
11. Antigen site dari HAV merupakan paparan beberapa bagian dari
VP1 dan VP3 pada permukaan kapsid
12. Replikasi HAV terjadi di sitoplasma hepatosit terinfeksi melalui
mekanisme yang melibatkan RNA-dependent RNA polymerase
Patogenesis
Penularan HAV secara dapat melalui beberapa cara yaitu:
1. Oral fecal
2. Anal-oral
3. Transfusi darah
Virus Hepatitis A masuk lewat saluran cerna kemudian melalui
sirkulasi enterohepatik menuju hati dan masuk dalam hepatosit.
Kemungkinan terjadi replikasi virus lokal di tempat masuk virus
sebelum akhirnya menyebar ke hepatosit melalui sirkulasi
enterohepatik. Virus ini tidak bersifat sitopatik terhadap hepatosit.
Kerusakan sel hati terjadi karena reaksi imunologik.1, 23 Limfosit T
sitotoksik berperan dalam reaksi imunologik ini.1, 4 Masa inkubasi
berkisar15-45 hari (rata-rata 1 bulan)
Infeksi virus mengaktifkan respon imun nonspesifik (innate
immunity) dalam hepar. Hepatosit yang terinfeksi akan dikenali oleh
Natural Killer sehingga menginduksi keluarnya sitokin proinflamasi
termasuk interferon. Fase innate immunity ini merupakan awal
pengendalian replikasi virus. Respon ini tidak bersifat sitopatik sehingga
hanya sedikit bahkan tidak terjadi kerusakan hepatosit. Selanjutnya
innate immunity akan mengaktifkan respon imun spesifik baik seluler
maupun humoral. Respon ini yang selanjutnya akan menimbulkan
kerusakan hepatosit.3
II.3.4. Gejala Klinis
Fase infeksi hepatitis virus akut terdiri dari:
1. Fase inkubasi menurut WHO adalah asimptomatik, mulai terjadi
replikasi virus,danpenularan terbesar1
2. Fase prodromal
3. Fase ikterik
4. Fase konvalesen
Fase prodromal:
Berlangsung sekitar 1hari-2 minggu (umumnya 5-7 hari)
Gejala tidak spesifik seperti kehilangan nafsu makan(anoreksia),
mual, muntah, fatik,kelemahan,demam ringan, mialgia, sakit kepala,
flu-like symptom, nyeri ulu hati
Fase ikterik:
Gejala prodromal menghilang
Ikterik pada membran mukosa,sklera, dan kulit
Hati membesar dan nyeri
Urin berwarna gelap, tinja pucat
Gatal, dan kehilangan berat badan
Bilirubin total > 20-40 mg/dL
Fase konvalesen:
Ikterik menghilang
Gejala konstitusional menghilang
Masih terdapat pembesaran hepar dan titer enzim hepar agak tinggi
HAV dapat dideteksi dalam tinja pada minggu 1 hingga minggu ke
6, viremia terjadi pada minggu 1 – minggu ke 6, peningkatan enzim
Alanin Aminotransferase terjadi sejak terjadi infeksi kemudian mencapai
puncaknya sekitar minggu ke-4 dan mulai menurun minggu ke-5. IgM
anti HAV mulai terlihat pada minggu 1 mencapai puncak minggu ke-4
dan 5 dan mulai menurun pada minggu ke 6-7 dan menghilang setelah
minggu ke-12. IgM anti HAV mulai timbul minggu ke-2 dan menetap
selama beberapa tahun.
II.3.6. Pemeriksaan Laboratorium
Pemeriksaan Hematologi Rutin
1. Selama fase akut dapat dijumpai leukopenia dengan neutropenia
dan limfopenia. Selain itu sekitar 2-20% dapat dijumpai limfosit
atipik
2. Komplikasi infeksi akut dapat menyebabkan terjadi penurunan
jumlah eritrosit, leukopenia, dan trombositopenia
3. Protrombin Time dapat meningkat bila terjadi nekrosis hepar yang
meluas, bila ini dijumpai maka prognosisnya buruk
Pemeriksaan Kimia Klinik
1. Peningkatan bilirubin total mencapai 5-20 mg/dL.3 Peningkatan
bilirubin total akan mencapai puncaknya setelah peningkatan
aktivitasenzim ALT serum dan menurun lebih lambat dibandingkan
aktivitasenzim ALT serum namun kembali lagi ke kadar normal
setelah 3 bulan.
2. Aktivitas enzim ALT meningkat hingga 20X dari nilai rujukan
selama infeksi akut.
3. Aktivitas enzim ALP dapat meningkat ringan akibat kolestasis
4. Aktivitas enzim GGT dapat meningkat ringan bila terjadi kolestasi
Pemeriksaan serologi infeksi virus Hepatitis A meliputi:
1. IgM anti HAV, pemeriksaan IgM anti HAV lebih bernilai klinis
dilakukan untuk mendiagnosis infeksi akut hepatitis A.
2. Total anti HAV
Gambaran serologi infeksi virus hepatitis A dapat dilihat pada
Gambar II.4.
II.3.7. Komplikasi
Komplikasi infeksi HAV adalah:1
1. Kolestatik
2. Relapse karena belum terjadi fase penyembuhan infeksi HAV
3. Fulminan
II.3.8. Pencegahan
Pencegahan infeksi HAV menurut CDC adalah:
1. Higine yang baik yaitu mencuci tangan dengan sabun sebelum dan
sesudah makan, mengolah bahan makanan, dan sesudah buang air
besar.
2. Sanitasi yang baik yaitu sumber air bersih yang baik dan lingkungan
yang terjaga kebersihannya.
3. Pencegahan dengan imunisasi hepatitis A.
4. Pemberian imunoglobulin sebelum dan sesudah paparan menurut
CDC.
II.4. HEPATITIS B AKUT
II.4.1. Etiologi
Penyebabnya adalah virus hepatitis B. Virus ini mempunyai ciriciri sebagai berikut:
1. Famili hepadnavirus
2. Double stranded DNA ukuran 42 nm
3. Tersusun atas inti nukleokapsid ukuran 27 nm(HBcAg)
4. Lapisan lipoprotein disebelah luar dikelilingi oleh membran
lipoprotein mengandung antigen permukaan (HBsAg)
Antigen HBV adalah:
1. HBsAg
a. Merupakan protein envelope yang diekspresikan di atas
permukaan luar dari virion dan diatas struktur tubular dan
sperik kecil
b. Konsentrasi dalam darah mencapai 500 µg/mL
c. Merupakan produk dari Gen S HBV
2. HBcAg
a. Antigen yang diekspresikan diatas permukaan inti
nukleokapsid
b. Antigen ini dihasilkan oleh gen C,translasinya dimulai dari
regio inti (core region)
c. Tidak mempunyai peptida sinyal, tidak disekresi, melekat
dalam partikel nukleokapsid dan berikatan dengan RNA serta
mengandung DNA HBV
3. HBeAg
a. Protein nukleokapsid nonpartikulat dan mudah larut (soluble)
b. Antigen ini dihasilkan oleh gen C, translasinyadimulai pada
regio preinti (precore region)
c. Memiliki peptid sinyal yang akan berikatan dengan smooth RE
sehingga HBeAg disekresikan ke dalam sirkulasi
II.4.2. Siklus Hidup Virus Hepatitis B
1. Virion berikatan dengan reseptornya di permukaan hepatosit
2. Virus masuk dalam sitoplasma melalui proses fusi membrane direk
dan melepaskan selubung luar.
3. Inti nukleokapsid masuk dalam inti sel hepatosit melalui proses
difusi pasif atau microtubule dependent transport. Genom virus
yang telah terlepas selubungnya di sitoplasma akan memasukkan
naked DNA ke dalam inti sel
4. Sintesis DNA double stranded lengkap dalam inti hepatosit
:pertama terjadi perbaikan genom virus (misalnya gap dalam
genom strand positif diisi) dan dibentuk covalently closed circular
DNA (cccDNA) sehingga terbentuk double stranded lengkap.
Sintesis cccDNA dikatalisis oleh DNA polymerase virus
5. Sintesis genom dan pregenom RNA dan transkrips virus untuk
pembentukan protein virus. cccDNA merupakan template untuk
sintesis dari transkrip genom dan subgenom yang dikatalisis oleh
RNA polymerase II pejamu. Setiap 4 transkrip virus mayor
diekspresikan oleh promoternya sendiri. Promoter inti merupakan
pusat dari replikasi karena promoter ini mengontrol produksi
genom RNA yang merupakan template untuk sintesis DNA tanpa
strand (DNA minus-strand)selanjutnya
6. Translasi transkrip virus : Transkrip RNA virus dibawa ke
sitoplasma dan terjadi translasi envelope virus, core, precore, dan
protein X serta DNA polymerase virus
7. Enkapsidasi: enkapsidasi terjadi dalam sitoplasma. Reaksi ini
dimulai dengan terbentuknya ikatan polimerase virus dengan
struktur stem-loop unik pada 5’end RNA genom. Struktur stemloop bertindak sebagai sinyal enkapsidasi untuk perakitan core
(inti) virus (mengandung 180 molekul protein inti) dan terjadi
secara simultan dengan sintesis DNA
8. Transkripsi reverse (reverse transcription) dan sintesis strand
DNA : pusat dari replikasi HBV adalah produksi intermediat RNA
diikuti dengan sintesis DNA virus oleh RT dan sebagian besar
proses tersebut terjadi dalam inti virus (viral core) di sitoplasma
hepatosit. Dua strand DNA HBV dibuat berurutan pada proses
replikasi DNA konvensional. Template untuk minus strand adalah
mRNA pregenomik dan template untuk sintesis plus strand adalah
DNA minus-strand. Sintesis DNA minus-stranddiawali oleh enzim
polimerase virus yang akan menggunakan penonjolan dari stemloop sebagai template awal. Melalui sintesis plus-strand, template
RNA dihancurkan oleh aktivitas RNAase spesifik yang terdapat
dalam polimerase virus. Bila sintesis minus-strand lengkap, sintesis
plus-strand diawali dengan penggunaan primer RNA pada 5’end
RNA pregenomik
9. Envelopment (Pembentukan Selubung): Setelah replikasi lengkap,
inti virus dibawa ke dalam inti sel atau melewati retikulum
endoplasmik atau apparatus Golgi. Pada tempat tersebut inti virus
mendapat protein-protein envelope (surface, L, dan M) sebelum
keluar sel melalui transpor vesikuler. Protein envelope dari HBV
diarahkan ke retikulum endoplasma oleh urutan spesifik (specific
sequences) gen S. Selama inti virus melewati retikulum
endoplasma, protein ini akan menyelubungi inti virus melalui
proses penggabungan dengan lipid dari retikulum endoplasma.
Protein pre-S1 mengandung reseptor yang akan memfasilitasi
perlekatan permukaan sel virus dengan hepatosit . Pada infeksi
dini, inti nukleokapsid dibawa kembali ke inti sel hepatosit dan
terjadi sintesis plus-strand lengkap dan pembentukan molekul
cccDNA stabil. Molekul cccDNA membentuk sumber template
transkripsional sehingga setelah pembelahan hepatosit terjadi
penyebaran infeksi pada sel anak. Bila infeksi tetap berlangsung,
maka inti nukleokapsid dibawa keluar dari hepatosit sehingga
terjadi penyebaran infeksi di luar hepar
Patogenesis
Penularan infeksi HBV dapat melalui beberapa cara antara lain:
1. Seksual
2. Parenteral
3. Perinatal
4. Kontak dg penderita (horizontal)
Imunopatogenesis
Pada infeksi akut virus Hepatitis B, terjadi respon imun spesifik
yang melibatkan MHC kelas I maupun kelas II. Respon imun yang
melibatkan MHC kelas I menyebabkan efek sitolitik terhadap hepatosit
terinfeksi sehingga menimbulkan kerusakan hepatosit dan
menimbulkan gejala klinis.5 Skema imunopatogenesis infeksi HBV dapat
dilihat pada gambar berikut
.4.4. Gejala Klinis
Gejala klinis sesuai dengan gejala klinis infeksi hepatitis virus
akut. Masa inkubasi infeksi VHB sekitar 30-180 hari (4-12 minggu). Fase
penyembuhan (konvalesen) berlangsung > 12 minggu. Gejala klinis
infeksi hepatitis akut dan pemeriksaan biokimia hati kembali normal
sekitar 3-4 bulan setelah onset ikterik bila tidak terjadi komplikasi.
II.4.5. Pemeriksaan Laboratorium
II.4.5.1. Pemeriksaan Hematologi
Hasil pemeriksaan hematologi antara lain adalah:
1. Netropenia dan limfopenia sementara diikuti dengan limfositosis
relatif
2. Bila terjadi komplikasi infeksi akut kadang-kadang ditemukan
gambaran anemia aplastik
3. Limfosit atipik (bervariasi antara 2-20%)
4. Protrombin time memanjang pada infeksi akut dan bila
berlangsung lama kemungkinan terdapat gangguan sintesis hati
II.4.5.2. Pemeriksaan Kimia Darah
1. Peningkatan aktivitas enzim ALT dan AST. Tingginya peningkatan
aktivitas enzim ini tidak berkorelasi dengan manifestasi klinis,
namun besarnya aktivitas ALT berkorelasi dengan tingkat
kerusakan sel hepar. Peningkatan aktivitas enzim
aminotransferase dapat mencapai lebih dari 500 U/L.
2. Kadar bilirubin total serumbisa lebih dari 2,5 mg/dL (43 μmol/L).
Ikterik dapat terlihat di sklera atau kulit bila total bilirubin lebih
dari 2,5 mg/dL, dan dapat meningkat hingga 5-20 mg/dL.Kadar
bilirubin serum menurun lebih lambat dibandingkan
aminotransferase.
3. Aktivitas alkali phosphatase normal atau meningkat ringan
4. Kadar albumin serum normal atau menurun bila terjadi
komplikasi pada infeksi akut.
5. Aktivitas Gamma Globulin Transferase (GGT) meningkat karena
terjadi kolestasis intrahepatik akibat inflamasi hepatosit
Pemeriksaan Serologi
Pemeriksaan serologi infeksi virus hepatitis B akut dapat dilihat pada
tabel dan gambar dibawah ini:
Petanda serologi yang pertama kali muncul pada infeksi virus
hepatitis B sebelum terjadi peningkatan aktivitas aminotransferase dan
gejala klinik adalah HBsAg.HBsAg dapat terdeteksi selama fase ikterik
hingga 4 bulan setelah onset ikterik.Setelah HBsAG menghilang akan
timbul anti HBsAg (anti HBs). HBcAg tidak dapat terdeteksi dalam
serum karena melekat dalam selubung HBsAg sehingga yang dideteksi
adalah anti HBc. Anti HBc terdeteksi dalam serum 1-2 minggu setelah
timbulnya HBsAg dan sebelum munculnya anti HBs. Periode antara
tidak terdeteksinya HBsAg dan mulai munculnya anti HBs dinamakan
dengan window periode (periode jendela). Pada periode ini, untuk
menegakkan infeksi virus hepatitis B akut dilakukan pemeriksaan IgM
anti HBc.
Komplikasi infeksi akut VHB:2
1. Hepatitis fulminan
2. Hepatitis kronik
3. Beberapa komplikasi yang jarang terjadi antara lain pankreatitis
dan anemia aplastik
Faktor Risiko
Faktor risiko terkait infeksi virus hepatitis B menurut CDC yang
paling banyak adalah tidak diketahui yaitu sekitar 32%, setelah itu
diikuti berturut-turut berganti-ganti pasangan seksual, pemakaian obat
injeksi, kontak seksual dengan pasien hepatitis B, pasangan LSL, kontak
dengan pasien hepatitis B yang tinggal satu rumah, peralatan medis,
hemodialysis, dan transfusi darah. Secara lengkap dapat dilihat pada
gambar dibawah ini.
Hepatitis kronis adalah peradangan hati yang berlangsung
setidaknya 6 bulan. Dibedakan berdasarkan tempat dan besarnya
kerusakan pada hati. Bentuknya dapat berupa hepatitis kronis ringan
yang sering disebut dengan hepatitis persisten kronik dan hepatitis
lobular kronik maupun hepatitis kronik yang berat yang disebut
hepatitis aktif kronik. Saat ini hepatitis kronis dibedakan berdasarkan
penyebab, histologi, dan perkembangan penyakit.
Berdasarkan penyebabnya dibedakan menjadi:
1. Hepatitis viral kronik yang disebabkan oleh virus hepatitis B,
hepatitis B dan D, hepatitis C, atau virus lain yang potensial
2. Hepatitis autoimun
3. Hepatitis kronik akibat obat
4. Atau hepatitis kronik kriptogenik
Berdasarkan gambaran histologi pada biopsi hati, hepatitis kronis
dibedakan menjadi:
1. Tingkat nekrosis periportal nekrosis piecemeal atau hepatitis
interface
2. Nekrosis bridging menghubungkan regio portal dengan vene
sentralis
3. Tingkatan inflamasi portal
Berdasarkan derajat fibrosis :
0 no fibrosis
1 mild fibrosis
2 moderate fibrosis
3 fibrosis berat, termasuk bridging fibrosis
4 sirosis
Klasifikasi baru:
Hepatitis persisten kronik
Terdapat infiltrasi sel MN tetapi terlokalisasi hanya di regio portal.
Limiting plate dari hepatosit periportal intak dan tidak ada perluasan
proses nekrosis ke lobulus hati. Adanya bentuk cobblestone dari
hepatosit mengindikasikan adanya aktivitas regenerasi walaupun dapat
ditemukan fibrosis minimal periportal. Tidak ada sirosis. Biasanya tidak
ditemukan gejala pd pasien atau hanya gejala konstitusional ringan
seperti kelelahan, anoreksia, dan nausea. Terdapat pembesaran hepar
tanpa disertai stigmata penyakit hati kronik. Aktivitas aminotransferase
meningkat ringan.
Perkembangan progresif ke arah lesi yang lebih berat (hepatitis
aktif kronik dan sirosis) sering terjadi pada pasien dengan autoimun
atau hepatitis persisten kronik idiopatik, namun progresifitas pada
pasien hepatitis virus persisten kronik dan hepatitis persisten kronik
terjadi setelah remisis spontan atau terapeti dari hepatitis autoimun.
Nomenklatur baru mengklasifikasikan hepatitis persisten kronik
menjadi hepatitis kronik ringan atau minimal (berdasarkan
tingkatannya) dan fibrosis ringan atau tanpa fibrosis (berdasarkan
stadiumnya)
Hepatitis lobular kronik
Pada pasien dengan hepatitis lobular kronis, selain ditemukan
inflamasi di daerah portal, juga ditemukan nekrosis dan inflamasi pada
lobulus hati.
Hepatitis aktif kronik
Hepatitis ini ditandai dengan nekrosis hepatik berkelanjutan,
inflamasi portal/periportal dan sedikit perluasan menjadi inflamasi
lobuler, serta fibrosis. Hepatitis kronik aktif dapat ringan hingga berat
dan perkembangan penyakitnya progresif serta menyebabkan sirosis,
gagal hati, dan kematian.
Karakteristik morfologinya adalah:
1. Infiltrat mononuklear di daerah portal dan meluas ke dalam
lobulus hati (pada tipe autoimun ditandai dengan adanya sel
plasma di daerah infiltrat)
2. Kerusakan hepatosit di perifer lobus dengan erosi di limiting
plate dari hepatosit di sekeliling triad portal (piecemeal nekrosis
atau hepatitis perbatasan)
3. Septum jaringan ikat disekitar area portal dan meluas hingga ke
dalam lobus, sel-sel parenkim terisolasi dalam cluster dan
menutupi duktus biliaris
4. Regenerasi hepatoseluler yg ditandai dengan formasi rosette.
Penebalan plate sel hati, dan pseudolobules regeneratif
5. Proses ini bisa tidak beraturan dengan perluasan ke lobuluslobulus hati atau difus.
Penyebab hepatitis virus kronik adalah virus hepatitis B, C, dan D
dgn infeksi bersama dengan VHB.
III.2.1. Hepatitis B Kronik
Penyakit HBV kronik didefinisikan sebagai inflamasi nekrotik pada
hati akibat VHB. 2 Perkembangan penyakit hepatitis B akut menjadi
kronik bervariasi sesuai umur. Bila hepatitis B akut terjadi saat bayi dan
balita maka kemungkinan menjadi hepatitis kronik sekitar 90%.1, 3 Fase
hepatitis B kronik berdasarkan replikasi virusnya dibedakan menjadi:1
1. Fase replikatif, pada fase ini cenderung lebih berat. Penanda
serologi yang dapat dijumpai adalah:
a. HBeAg positif
b. DNA HBV positif
c. HBcAg positif
Infektifitas pada fase ini sangat tinggi sehingga sangat infeksius.
Selain itu, dapat dijumpai kerusakan hepar lainnya.
2. Fase non replikatif merupakan fase ringan atau minimal atau
asimptomatik carier. Penanda serologi yang dapat dijumpai
adalah:
a. HbeAg positif
b. DNA HBV dideteksi dgn hibridisasi
c. Anti HBe positif
d. HBcAg negatif
Infektifitas pada fase ini terbatas dan kerusakan hepar minimal.
Kriteria WHO menetapkan bahwa hepatitis B kronik ditandai dengan:3
1. Infeksi terjadi lebih dari 6 bln dengan kadar serum HBsAg menetap
dan IgG anti HBcAg menetap.
2. Tidak ditemukan anti HbsAg.
3. HbeAg dan DNA HBV dapat dideteksi dengan konsentrasi tinggi
tetapi menghilang bila replikasi virus berhenti atau terjadi mutasi
yang mencegah sintesis dari prekursor protein precore virus
HbeAg
Fase replikasi virus menurut WHO dibedakan menjadi 3 yaitu:3
1. Fase replikasi tinggi, ciri fase replikasi adalah:
a. HBsAg, HBeAg, dan DNA HBV positif pada serum
b. Peningkatan aktivitas enzimtransaminase
c. Resiko menjadi sirosis tinggi
2. Fase replikasi rendah, ciri fase replikasi ini adalah:
a. HBeAg negatif
b. DNA HBV menurun atau negatif
c. Anti-HBeAg positig
d. Perubahan serologi dari hilangnya DNA HBV dan HBeAg
menunjukkan adanya serokonversi
3. Fase nonreplikasi
a. Tidak dijumpai marker replikasi virus atau dibawah batas
deteksi
b. Bila terjadi sirosis akan menetap
Kriteria karier inaktif adalah:
a. HBsAg positif sedangkan HBeAg negatif,
b. Kadar HBV DNA menurun
c. Aktivitas enzi ALT normal lebih dari 6 bulan
d. Imunotoleran dan berisiko terjadinya integrasi HBV DNA ke dalam
DNA inti hepatosit sehingga cenderung terjadi kanker hati pada
kehidupan selanjutnya2
Reaktivasi
a. Pasien dengan status karier kemudian terjadi peningkatan aktivitas
enzim transaminase hati dan peningkatan kadar DNA HBV
b. HBeAg positif
Penyembuhan Infeksi
Fase penyembuhan terjadi bila pasien dengan riwayat infeksi hepatitis
akut dan kronis tidak didapatkan penanda HBsAg atau HBV DNA.
Aktivitas enzim transaminase hati kembali normal. Sedangkan anti HBc
dapat positif selama 5-10 tahun sehingga berisiko untuk menularkan
penyakit melalui donor organ atau reaktivasi infeksi HBV bila mendapat
terapi imunosupresan.
Selain itu pemberian imunosupresan (prednison, methotrexate,
atau kemoterapi) dapat menyebabkan fase ini berkembang menjadi
penyakit hati aktif.
Koinfeksi
Koinfeksi adalah infeksi HBV disertai infeksi HDV, HCV, atau HIV2
III.2.1.1. Diagnosis Laboratorium
Pemeriksaan Kimia Klinik
1. Peningkatan aktivitas enzim ALT (menurut WHO aktivitasnya
normal-200 IU/L, sedangkan menurut Harrison bervariasi antara
100-1000 IU/L). Bila telah terjadi sirosis hepatis maka aktivitas
enzim AST lebih besar dibandingkan ALT
2. Aktivitas enzim ALP cenderung normal atau sedikit meningkat.
3. Pada kasus yang berat, terjadi peningkatan moderat dari kadar
bilirubin serum yaitu antara 3-10 mg/dL
4. Hipoalbuminemia dan PT memanjang pada end-stage atau kasus
yang berat3
Pada Flares of hepatitis B infection, terjadi peningkatan intermiten kadar
aminotransferase serum > 10X batas atas normal.2
Pemeriksaan Serologis
Penanda serologi pada hepatitis B kronik dapat dilihat pada gambar
dibawah ini. Pada hepatitis kronik terdapat persistensi kadar HBsAg dan
tidak didapatkan IgG anti HBc.
Fase infeksi kronis virus hepatitis B terdiri dari fase toleransi imunologi,
fase immune clearance, fase inactive carrier state, serta fase reaktivasi.
Gambaran laboratorium pada masing-masing fase dapat dilihat pada
gambar berikut ini
Pemeriksaan ulang dilakukan pada sampel yang sama atau
pengambilan sampel ulang apabila ditemukan ketidaksesuaian hasil
pemeriksaan seromarker hepatitis B. Ketidaksesuaian hasil pemeriksaan
tersebut antara lain adalah:
1. HBsAg positif/anti HBc negatif
HBsAg positif yang disertai dengan anti HBc negatif hanya terjadi
selama masa inkubasi hepatitis B akut, sebelum onset gejala klinik
dan kelainan fungsi hati
2. HBsAg positif/anti HBs positif/anti HBc positif
Hasil seperti ini jarang terjadi. Biasanya hasil ini terjadi pada masa
resolusi infeksi akut hepatitis B, karier kronik yang mempunyai
gangguan hati berat, atau karier yang terpapar subtype heterolog
dari HBsAg
3. Hanya anti HBc yang positif
Hasil ini pada paska infeksi hepatitis B tetapi belum terjadi
penyembuhan sempurna.
4. HBeAg positif/HBsAg negatif
Jarang terjadi
5. HBeAg positif/anti HBe positif
arang terjadi
6. Hanya anti HBs positif pada pasien yang belum diimunisasi
asil ini kemungkinan terjadi akibat transfusi darah sehingga terjadi
transfer pasif anti HBs dari donor yang sudah diimunisasi ke pasien
yang menerima transfusi faktor koagulasi, setelah pemberian
imunoglobulin, atau neonatus dari ibu paska infeksi hepatitis B
virus. Antibodi yang didapatkan secara pasif akan menghilang
seluruhnya setelah 3 sampai 6 bulan, sedangkan antibodi yang
didapatkan secara aktif melalui imunisasi atau paska infeksi virus
hepatitis B akan bertahan selama beberapa tahun.
Protein mutan dari strain HBV mutan mungkin luput dari
pemeriksaan laboratorium untuk diagnosis. Untuk itu perlu dilakukan
uji diagnosis adanya penanda serologi yang berbeda sehingga dapat
memberikan diagnosis yang benar. Kits untuk diagnostik sebaiknya
mengandung antibodi terhadap berbagai protein mutant untuk
mendapatkan hasil yang lebih baik
Laboratorium Hematologi
1. Trombosit rendah kurang dari 100.000/uL menandakan
fibrosis lanjut
2. Lekosit rendah
3. Feritin dan saturasi iron meningkat menandakan
hemakromatosis2
III.3. Hepatitis C Kronik
Infeksi HCV kronik terjadi pada 85% pasien setelah infeksi akut.
Sebagian besar pasien asimptomatik disertai peningkatan kadar
aminotransferase dan tidak dijumpai kelainan pada pemeriksaan fisik.
Gejala klinis yang sering dijumpai adalah kelelahan dan nyeri perut
kanan atas. Demam subfebris, mual, muntah, mialgia, dan artalgia
adalah gejala lain yang dapat ditemukan. Sepertiga penderita infeksi
HCV kronis mempunyai kadar ALT normal, sedangkan 25%nya terdapat
peningkatan ALT < 2X nilai batas atas normal. Peningkatan nilai ALT
yang menetap terjadi pada 26% kasus sedangkan 40%-70% terjadi
peningkatan ALT secara intermitten. Pada 17% pasien dengan
pemantauan jangka panjang terjadi resolusi ALT hingga mencapai batas
normal. Peningkatan ALT hingga 10X berhubungan dengan nekrosis
piecemeal yang berat.2
III.3.1. Perjalanan Penyakit Hepatitis C
Perjalanan penyakit infeksi HCV dapat dilihat pada Gambar III.
Infeksi HCV kronis dapat berkembang menjadi sirosis pada 20%-
25% pasien dengan imunokompeten dalam 20 tahun setelah onset
infeksi. Faktor-faktor yang mempercepat perkembangannya menjadi
sirosis adalah:
1. Jenis kelamin (laki-laki lebih cepat menjadi sirosis)
2. Genetik (Jepang lebih berisiko dibandingkan bangsa Amerika)
3. Umur terkena paparan penyakit (bila terpapar HCV pada umur > 40
tahun lebih berisiko menjadi sirosis)
4. Lamanya infeksi HCV (makin lama infeksinya makin berisiko
menjadi sirosis)
5. Transmisi (transmisi karena transfusi darah lebih berisiko menjadi
sirosis dibandingkan penularan melalui jarum suntik)
6. Kondisi lain seperti penyakit hati karena alkohol, merokok, infeksi
HIV, dan infeksi HBV dapat meningkatkan risiko terjadinya sirosis
III.3.2. Pemeriksaan Laboratorium Kimia
ALT (Alanin Aminotransferase)
Aktivitas enzim ini dapat normal atau fluktuatif. Hasil normal
aktivitas enzim ALT tanpa disertai pemeriksaan lain tidak
menyingkirkan kemungkinan infeksi aktif, penyakit hati progresif, atau
sirosis. Pada pasien dengan terapi antivirus, ALT kembali normal tidak
mencerminkan keberhasilan terapi. Namun peningkatan ALT dapat
menetap walaupun virus telah hilang.4
III.3.3. Pemeriksaan Serologi
Anti-HCV
1. Anti HCV akan menurun bertahap pada pasien yang mengalami
resolusi spontan.
2. HCV menjadi negatif sesudah 18-20 tahun disertai hilangnya virus
secara spontan dari dalam darah.
3. Pemeriksaan menggunakan EIA generasi kedua dan ketiga yang
menggunakan protein inti dapat mendeteksi antibodi dalam 4-10
minggu setelah infeksi.
4. False positif dapat terjadi pada individu tanpa faktor risiko dan
gejala penyakit hati seperti donor darah dan pekerja sehat sehingga
harus dikonfirmasi dengan pemeriksaan lain
Pemeriksaan imunoblot rekombinan dapat digunakan untuk
konfirmasi hasil positif pada EIA terutama direkomendasikan risiko
rendah seperti bank darah
6. False negatif terjadi pada individu dengan imunokompromis seperti
penderita HIV-1, gagal jantung, dan penderita HCV dengan
essential mixed cryoglobulinemia.
III.3.4. Pemeriksaan Molekuler
1. RT-PCR untuk RNA HCV
2. Viral Load
III.4. Hepatitis D
Infeksi kronik HDV biasanya merupakan superinfeksi dengan infeksi
HBV. Diagnosis superinfeksi HBV-HDV :
1. Biasanya terdapat infeksi HDV menetap
2. Viremia HDV dalam serum selama fase preakut
3. Titer IgM dan IgG anti HDV tinggi selama fase akut dan menetap
4. Titer HBsAg menurun saat HDAg tampak di serum
5. Progresi ke arah kronisitas berhubungan dengan menetapnya kadar
IgM dan IgG anti HDV yang tinggi
6. HDAg dan RNA HDV tetap terdeteksi dalam serum dan hati
7. Viremia berhubungan dengan penyakit hati aktif
Hepatitis kronik autoimun
Hepatitis autoimun ditandai dengan nekrosis dan inflamasi
berkelanjutan biasanya disertai fibrosis dan cenderung berkembang
menjadi sirosis dan gagal hati.1
I.1.1. Etiologi
Etiologi belum diketahui namun diduga karena perubahan dalam
sistem imun tubuh.6 Namun autoantibodi dan beberapa gambaran
adanya autoimun tidak dijumpai di seluruh kasus.2 Kadar gamma
globulin serum biasanya meningkat. Sel LE dapat ditemukan pada 15%
kasus dan biasanya disebut dengan hepatitis lupoid. Antibodi otot polos
dan antibodi mitokondria ditemukan pada hepatitis lupoid namun tidak
demikian dengan lupus eritematosus sistemik.
Imunopatogenesis
Hepatitis aktif kronik autoimun merupakan penyakit kelainan
pengaturan sistem imun karena kerusakan pada pengaturan sel T
supresor. Akibatnya terjadi autoantibodi yang menyerang antigen
permukaan hepatosit.1, 6 Mekanisme imun seluler berperan dalam
patogenesis penyakit ini.Sedangkan mekanisme imun humoral berperan
dalam manifestasi ekstrahepatik seperti arthalgia, arthritis, vaskulitis
kutaneus, dan glomerulonefritis akibat penimbunan kompleks imun di
jaringan.1
I.1.3. Gambaran Klinis
Gambaran klinis mirip dengan penyakit autoimun. Biasanya
menimpa wanita usia muda hingga pertengahan dan puncak insidennya
sekitar menopause. Onsetnya biasanya berat. Pasien biasanya merasa
tidak enak badan dan diikuti dengan ikterik. Bila ikterik menetap, maka
kemungkinan adalah hepatitis kronik. Tidak jelas apakah penyakit ini
diawali dengan hepatitis virus akut atau terjadi saat pasien mengalami
hepatitis aktif kronik jangka panjang.1
Gejala klinis antara lain:1, 2
1. Kelelahan (merupakan gejala yang umum terjadi pada hepatitis
kronis)
2. Ikterik (merupakan gejala pada lebih dari 50% kasus)
3. Lemah
4. Anoreksia
5. Rasa tidak nyaman di abdomen regio kanan atas
6. Amenore sekunder atau menarche terlambat
7. Jerawat
8. Arthalgia
9. Kadang disertai dengan dekompensasi hepatik seperti asites dan
perdarahan varises
I.1.4. Pemeriksaan Fisik
Umumnya pada pemeriksaan fisik ditemukan hepatomegali dan
ikterik. Lien mungkin teraba pada 50% kasus dan kemungkinan
ditemukan spider nervi namun bukanlah indikasi terjadinya sirosis.
Gambaran dekompensasi hati mungkin ditemukan namun bukanlah
gejala yang umum terjadi. Pada pasien dengan eksaserbasi akut (burned
out) dapat ditemukan gejala tersebut yaitu asites (20%), encephalopati
hepatik (14%), atau perdarahan varises (8%).2
I.1.5. Pemeriksaan Laboratorium
1. Perubahan aktivitas enzim hepar yaitu peningkatan aktivitas
aminotransferase dalam serum (pada beberapa kasus peningkatan
dapat melebihi 1000 IU/L)
2. Peningkatan kadar bilirubin direk.2 Pada beberapa pasien bilirubin
serum normal. Namun pada keadaan yang lebih berat mencapai
51-171 mg/dL1
3. Peningkatan ALP serum minimal hingga moderat.1
4. Hipergammaglobulinemia (lebih dari 2,5 g/dL
5. Koagulopati
6. Hipoalbuminemia.
7. Pemeriksaan sediaan hapus darah tepi menggambarkan
hipersplenisme (leukopenia dan atau trombositopenia dan atau
rendahnya hemoglobin). Keadaan ini biasanya mencerminkan
telah terjadinya sirosis.2
8. Anti nuclear antibody positif
9. Smooth muscle antibodies (tidak spesifik)
Pada autoimun hepatitis tipe I dapat dijumpai gambaran laboratorium
sebagai berikut:
1. Hiperglobulinemia
2. Gambaran lupoid
3. ANA positif
Autoimun hepatitis tipe II dapat dijumpai gambaran laboratorium
berikut:1
Anti LKM -1 (liver kidney microsom) (pada hepatitis C kronik
anti LKM)
Autoimun hepatitis tipe IIb
Kadar globulin serum normal
Titer anti LKM-1 rendah
Respon terhadap terapi interferon
Autoimun hepatitis tipe III:
ANA negatif
Anti LKM-1 negatif
Antibodi terhadap antigen hati terlarut yang terdapat pada
sitokeratin sitoplasmik hepatosit 8 dan 18
Karsinoma hepatoseluler merupakan keganasan kelima yang
sering terjadi dan ketiga keganasan penyebab kematian di dunia.Jumlah
kasus baru pertahun kurang lebih 560.000. International Agency for
Research on Cancer mengestimasikan insiden karsinoma hepatoseluler
pada tahun 2000 mencapai 14,97/100.000 (laki-laki) dan 5,51/100.000
(wanita), sedangkan angka kematian per-tahun hamper sama dengan
insiden karena rendahnya angka kesembuhannya yaitu sekitar
14,41/100.000 (laki-laki) dan 5,46/100.000 (wanita).
IV.2. ETIOLOGI
Etiologi karsinoma hepatoseluler antara lain adalah:
Infeksi virus hepatitis B kronis
Infeksi virus Hepatitis C kronis
Paparan aflatoksin dalam makanan
Sirosis akibat alkoholik kronis dan penyakit hati kronis lainnya
Genetik
IV.2.1. Infeksi Hepatitis B Kronis
Infeksi HBV merupakan faktor risiko terjadinya karsinoma
hepatoseluler yang akan meningkat pada pasien dengan sirosis.3 Lebih
dari 80% pasien dengan KHS disebabkan oleh HBV.4 Sekitar 0,1%-2%
pasien dengan infeksi kronis hepatitis B per-tahun akan menjadi sirosis
tergantung dengan lamanya replikasi HBV, beratnya penyakit, dan ada
tidaknya infeksi lain atau penggunaan alkohol
Pada pasien dengan sirosis tersebut sekitar 2%-10%nya akan
berisiko untuk berkembang menjadi karsinoma hepatoseluler
,
sedangkan menurut WHO sekitar 5 pasien dengan sirosis akan
berkembang menjadi KHS dan 60%-90% pasien KHS didahului dengan
sirosis.4 Faktor pejamu dan virus ikut mempengaruhi perkembangannya
hepatitis B kronis menjadi KHS. Beberapa strain HBV tertentu ada yang
predominate menjadi KHS.
Pasien dengan infeksi HBV dan karsinoma hepatoseluler, DNA
HBV diintegrasikan dalam DNA genom pejamu baik dalam sel-sel tumor
maupun sel-sel yang berdekatan (tidak termasuk hepatosit). Selain itu,
modifikasi ekspresi gen seluler terjadi melalui mutagenesis insertional,
pengaturan ulang kromosomal, atau aktivitas transaktivasi
transkriptional dari regio X dan pre-S2 genom HBV.2 KHS merupakan
hasil dari inflamasi kronis hepatitis B dan regenerasi seluler berulang
dari hepatosit dan biasanya terjadi setelah 25 sampai 30 tahun infeksi.3
Pemeriksaan laboratorium α-fetoprotein (AFP) serial pada carrier
HbsAg akan meningkat secara signifikan melebihi baseline pasien
(peningkatan lebih dari 100 µg/mL). Kadar AFP dan USG abdomen
merupakan pemeriksaan yang direkomendasikan terhadap carrier
HbsAg dengan sirosis untuk mengetahui adanya KHS.4
Bila KHS telah bermanifestasi klinis, maka medial survival
frequencynya < 3 bulan. Namun bila dapat dideteksi lebih awal maka
85% kesempatan untuk disembuhkan melalui pembedahan, iradiasi, dan
obat anti kanker.4 Untuk menurunkan prevalensi infeksi HBV kronis dan
insidensi KHS, maka vaksinasi pada bayi dan individu berisiko
merupakan cara yang efektif.
IV.2.2. Infeksi Hepatitis C Kronis
HCV kronis dapat menyebabkan KHS. Materi genetik HCV tidak
berintegrasi ke dalam DNA genom host sehingga mekanisme terjadinya
karsinoma pada HCV masih belum jelas. Infeksi HBV dan HCV dapat
terjadi bersamaan pada pasien dengan KHS namun gambaran klinis
antara infeksi tunggal maupun bersama tidak berbeda.2 Genotip dan
viral load HCV mempengaruhi perkembangan penyakit dan respon
terhadap terapi. Genotip 1b yang banyak ditemukan di negara barat
berhubungan dengan penyakit hati yang berat dan respon terapi sangat
rendah. Bila terjadi hepatitis persisten dengan tingginya kadar
aminotransferase pertahun merupakan prediktor signifikan
perkembangan infeksi HCV menjadi KHS. Pasien dengan hepatitis aktif
disertai koinfeksi HBV atau HIV dan penyebab lain penyakit hati kronis
seperti alkohol lebih sering menimbulkan komplikasi penyakit hati
kronis dan berkembang menjadi KHS.
Pasien dengan HCV positif dengan antibodi anti HbcAg positif
memiliki prevalensi tertinggi terjadinya sirosis, rendahnya kadar RNA
HCV, dan gangguan kemampuan respon terhadap terapi interferon.
Sedangkan pasien HCV kronis dengan koinfeksi HIV lebih cepat
progresifitasnya dan dapat berakhir menjadi sirosis, stadium terminal
penyakit hati, dan KHS. KHS karena infeksi kronis HCV merupakan
penyebab penting morbiditas dan mortalitas pada pasien dengan
koinfeksi.
IV.2.3. Paparan Aflatoksin pada Makanan
Paparan jamur aflatoksin dalam makanan merupakan faktor
risiko penting KHS.1 Mikotoksin ini menginduksi mutasi spesifik pada
kodon 249 (khususnya transversi G menjadi T)pada gen p53 yang
merupakan gen supresor tumor.1, 2 Hilangnya, inaktivasi, atau mutasi
dari gen p53 menyebabkan terjadinya tumorgenesis dan berperan
dalam pengaturan genetik dari kanker pada manusia.2
Aflatoksin merupakan derivat dari aspergillus flavustoxin yang
dihasilkan oleh 2 buah spesies jamur yaitu Aspergillus
flavusdanAspergillus parasiticus. A. Flavus terdapat tersebar luas di alam
(tanah, pembusukan tanaman, makanan, dan partikel-partikel) terutama
di tempat yang tinggi kelembaban udara dan temperaturnya. Tipe yang
paling toksik adalah aflatoksin B1. Aflatoksin dimetabolisme di hati oleh
sitokrom p450 dan sistem enzim glutathione S-transferase. Aflatoksin
B1 merupakan prokarsinogen yang akan diubah dalam hati menjadi
metabolit yang mutagenik aflatoksin B1-8,9-eksoepokside oleh sitokrom
p450 mikrosomal hati. Glutathione S-transferase dan enzim fase II lain
selanjutnya melakukan detoksifikasi metabolit reaktif DNA ini. Gen
Glutathione S-transferase M1 (GSTM1) memperlihatkan polimorfisme
genetik. Individu yang tinggal di daerah dengan kandungan aflatoksin
makanan tinggi dan memiliki genotipe GSTM1 null memiliki risiko
terkena KHS lebih tinggi. Bila individu terpapar aflatoksin disertai
dengan infeksi kronis HBV dan HCV lebih tinggi risikonya terkena KHS.
IV.2.4. Sirosis Alkohol dan Penyebab Penyakit Hati Kronik Lain
Sirosis meningkatkan risiko KHS. Risiko KHS pada hepatitis
kronik dan kerusakan hepatoseluler berkelanjutan lebih tinggi. Namun
autoimun hepatitis yang menyebabkan sirosis memiliki risiko KHS lebih
rendah.
IV.2.5. Genetik
Adanya riwayat keluarga yang menderita KHS di suatu daerah
dengan insiden KHS tinggi merupakan faktor risiko signifikan terjadinya
KHS, namun dasar biologis fenomena ini belum jelas. Penelitian
epidemiologi menunjukkan bahwa adanya alel resesif berperan untuk
risiko terjadinya KHS atau predisposisi familial untuk pemanjangan fase
replikasi HBV. Polimorfisme genetik dari sitokrom p450, glutathione Stransferase M1 (GSTM1), dan N-acethyltransferase (NAT2) seperti juga
polimorfisme p53 berperan pada risiko familial KHS.
IV.3. PATOGENESIS
Aktivasi onkogen dan inaktivasi supresor tumor berperan dalam
karsinogenesis. Aktivasi onkogen terjadi melalui aktivasi transkripsional,
amplifikasi gen, atau adanya aktivasi mutasi-mutasi gen yang termasuk
dalam kendali pertumbuhan seluler. Inaktivasi supresor tumor terjadi
melalui delesi genom, translokasi, atau mutasi atau melalui modifikasi
epigenetik seperti metilasi promoter. Sel somatik manusia memiliki
masa hidup tertentu secara in vivo dan menjadi tua setelah beberapa
kali pembelahan sel. Penuaan seluler dipicu oleh aktivasi 2 mekanisme
interdependen yaitu:
1. Mekanisme yang menyebabkan induksi terjadinya fase istirahat
siklus sel melalui aktivasi 2 supresor tumor yaitu p53 dan pRb
2. Mekanisme yang diaktifkan oleh pemendekan dan akhir
kromosom oleh proses pemendekan telomer setiap pembelahan
sel
Bila kedua mekanisme pengatur pertumbuhan sel ini diinaktifkan maka
akan menyebabkan pembelahan sel tidak dikontrol dan berkembang
menjadi kanker.1
Paparan zat karsinogen dapat menyebabkan aktivasi gen kanker
(oncogene) dan inaktivasi supresor tumor.Berdasarkan penelitian yang
ada, terjadinya KHS pada sirosis diduga karena terbentuknya lesi-lesi
preneoplastik berupa nodul-nodul makroregeneratif dengan displasia
hepatosit di beberapa tempat. Displasia dari small cell dan hiperplasia
adenomatosa merupakan lesi preneoplastik yang predominan. Namun
mekanisme terjadinya KHS masih belum jelas.1 Mekanisme terjadinya
KHS pada hepatitis virus kronik dapat dilihat pada Gambar IV.1. Faktorfaktor yang mempengaruhi KHS antara lain:
1. Gen supresor tumor seperti p53, retinoblastoma (Rb), p16,
axin1,smad2, smad4,M6P/IGF2R, BRCA2, dan DLC-1
2. Onkogen seperti c-fos, c-myc, c-erB-2, c-met, ß-catenin, dan
gankyrin
3. Faktor pertumbuhan dan jalur sinyal faktor pertumbuhan seperti
Insulin, Insulin-like growth factors (IGFs) I dan II yang
meningkatkan pertumbuhan hepatosit, IRS-1 yang mengaktifkan
mitogen-activated protein kinase cascade dan proliferasi sel
melalui up-regulation dan gen-gen pertumbuhan seluler serta
menginhibisi apoptosis, dan TGF-α yang kemungkinan berperan
dalam proliferasi seluler dari sel kanker
4. Panjang telomere dan aktivitas telomerase, sel-sel neoplastik
mengekspresikan telomerase.
5. Instabilitas mikrosatelit yaitu perubahan lengan panjang karena
insersi atau delesi unit ulangan dalam mikrosatelit DNA yang
terdapat pada DNA genomik tumor dibandingkan jaringan normal
6. Bagian yang rapuh dari kromosom yaitu tempat genetik spesifik
yang rentan terhadap terjadinya celah, pemecahan, dan
pengaturan ulang (rearrangement) pada kromosom metafase sel
yang dikultur pada keadaan tertentu yang menghambat replikasi
DNA.
7. Angiogenesis
GAMBARAN KLINIS
Gambaran klinis hepatoma tergantung pada beratnya penyakit
yang mendasarinya. Gejala yang sering adalah nyeri abdomen disertai
massa di abdomen di kuadran kanan atas. Bising (friction rub atau bruit)
dapat didengar diatas hati. Sekitar 20% penderita mengalami asites.
Jarang ditemukan ikterik kecuali bila terdapat deteorasi fungsi hati atau
obstruksi mekanik duktus biliaris. Beberpa pasien mengalami sindroma
paraneoplastik . Pada anak-anak dengan hepatoblastoma dapat
ditemukan isoseksual prekoksiti, sedangkan pada dewasa dapat terjadi
feminisasi dan ginekomastia namun sindroma ini biasanya terjadi pada
sirosis tanpa KHS sehingga sulit untuk membuktikan keterlibatan KHS.
Gejala lain adalah manifestasi kulit seperti dermatomyositis, pemfigus
foliacerus, dan tanda Leser-Trelat (onset dadakan dermatitis seboroik
dan jerawat (freckles, dengan peningkatan cepat dari jumlah lesi yang
menimbulkan pruritus.
GAMBARAN LABORATORIUM
Pada pemeriksaan laboratorium dapat dijumpai :
1. Peningkatan aktivitas enzim ALP dankadar α-fetoprotein dalam
serum
2. Abnormalitas tipe protrombin yang dihasilkan dari peningkatan
AFP
3. Eritrositosis akibat aktivitas eritropoeitin yang dihasilkan sel tumor
4. Hiperkalsemia akibat sekresi parathyroid-like hormone
5. Hiperkolesterolemia, hipoglikemia, polymyositis, acquired
porphyria, disfibrigonemia, cryofibrigonemia, dan peptida vasoaktif
yang berhubungan dengan diare.
6. Gambaran laboratorium sindroma paraneoplastik adalah
hiperkalsemi, eritrositosis, hipoglikemia (dimediasi oleh IGF),
tromboplebitis migrans, hipertensi arterial, hipokalemi dan
akhloridria dari sindroma diare cair.
Tukak duodenum merupakan bagian dari tukak peptik.Tukak
peptik secara anatomis didefinisikan sebagai suatu defek pada lapisan
mukosa atau submukosa yang berbatas tegas dan dapat menembus
muskularis mukosa hingga lapisan serosa sehingga dapat terjadi
perforasi.1
Tukak duodenum terjadi di bagian pertama dari duodenum dan
90% terdapat di 3 cm dari pilorus. Diameternya kurang dari 1 cm
bahkan terkadang mencapai 3-6 cm (giant ulcer). Dasar ulkus
mengandung zona nekrosis eosinofilik yang dikelilingi oleh jaringan ikat
fibrous.2
Patogenesis terjadinya tukak peptikum adalah ketidakseimbangan
antara faktor agresif yang merusak mukosa dengan faktor defensif yang
memelihara keutuhan mukosa lambung dan duodenum
V.2. ETIOLOGI
Faktor Agresif yang berperan dalam terjadinya tukak duodenum antara
lain :
1. Infeksi Helicobacter pylori
2. Obat antiinflamasi nonsteroid (OAINS)
3. Beberapa faktor lingkungn seperti merokok (dapat meningkatkan
kerentanan terhadap infeksi H.pylori dan menurunkan faktor
pertahanan serta menciptakan lingkungan yang sesuai untuk
H.pylori), stres, malnutrisi, makanan tinggi garam, defisiensi
vitamin, penyakit Zollinger Ellison Syndrome, Chron Disease, dan
faktor genetik.
Selain faktor agresif, penurunan faktor defensif yang memelihara daya
tahan mukosa gastroduodenal dapat menyebabkan penurunan daya
tahan mukosa sehingga mampu dirusak oleh faktor agresif.1
V.3. PATOGENESIS DAN PATOFISIOLOGI
Faktor mayor yang berperan dalam terjadinya tukak duodenum
adalah infeksi H.pylori dan OAINS. Asam lambung juga berperan dalam
kerusakan mukosa tetapi bukanlah yang utama.2
V.3.1. Patogenesis Infeksi H.pylori
Akibat infeksi H.pylori ditentukan oleh interaksi antara faktor
bakterial dan faktor pejamu.
Faktor Bakterial
1. H.pylori mampu memfasilitasi gastric residence, menginduksi
kerusakan mukosa, dan menghambat pertahanan pejamu (host
defense)
2. Regio spesifik dari genom bakteri mengkode faktor virulensi
seperti Cag A dan pic B
3. Faktor virulensi ini bersama dengan bagian lain dari bakteri dapat
menyebabkan kerusakan mukosa
4. Urease yang terdapat dalam bakteri akan menghasilkan NH3 yang
dapat menyebabkan kerusakan sel epitel
5. Bakteri menghasilkan faktor permukaan yang bersifat kemotaktik
terhadap neutrofil dan monosit sehingga berperan dalam
kerusakan sel epitel Enzim protease dan fosfolipase yang
dihasilkan oleh H.pylori akan memecah kompleks lipid
glikoprotein dari gel mukosa sehingga menurunan efektivitas
pertahanan pertama mukosa (first line of mucosal defense).2
Faktor Pertahanan Pejamu
Respon inflamasi terhadap infeksi H.pylori menyebabkan penarikan
neutrofil, limfosit (T dan B), makrofag, dan sel plasma. Respon
inflamasi dapat menyebabkan kerusakan mukosa.2
Mekanisme terjadinya ulkus duodenum akibat infeksi H.pylori
kemungkinan karena terjadi metaplasia gastrik dalam duodenum
sehingga akan mengikat kuman ini dan menyebabkan kerusakan lokal
sebagai akibat sekunder respon pejamu.
Hipotesis lain adalah infeksi H.pylori pada antral menyebabkan
peningkatan produksi asam lambung sehingga meningkatkan keasaman
duodenum dan terjadi kerusakan mukosa.
Pelepasan gastrin basal dan terstimulasi akan meningkat pada
infeksi kuman H.pylori dan sekresi somatostatin oleh sel D menurun
sehingga menginduksi peningkatan sekresi asam dan sitokin
proinflamasi (IL-8, TNF, dan IL-1) oleh sel parietal G dan D.
Patogenesis OAINS
Obat antiinflamasi nonsteroid dapat menghambat enzim
siklooksigenase (COX) sehingga menghambat pembentukan
prostaglandin dan prostasiklin. Prostaglandin dan prostasiklin berperan
dalam memelihara integritas mukosa gastroduodenal dan perbaikan
kerusakan mukosa. Gangguan terhadap pertahanan mukosa akan
menyebabkan kerusakan mukosa.
V.6. GEJALA KLINIS
Gejala klinis tukak duodenum antara lain nyeri abdomen di
epigastrium, panas seperti terbakar, tidak dijalarkan, terjadi 2-3 jam
sesudah makan atau malam hari, dan nyeri hilang bila makan atau
diberikan antasida. Biasanya nyeri dapat menyebabkan penderita
terbangun dari tidur (jam 00.00-03.00).
V.7. PEMERIKSAAN LABORATORIUM
Pemeriksaan laboratorium meliputi:3
1. Pemeriksaan Basal Acid Output dan Maximal Acid Output
2. Pemeriksaan Kadar Gastrin Serum
3. Deteksi H.pylori
a. Basal Acid Output (BAO)
BAO merupakan penentuan jumlah total asam yang disekresi
lambung pada keadaan basal tanpa rangsangan (stimulasi) selama
jangka waktu tertentu (biasanya 1 jam). Subyek yang akan diperiksa
harus dalam keadaan puasa dan bebas dari rangsangan makanan/obat
yang dapat mempengaruhi lambung. Mula-mula dilakukan aspirasi
sebanyak 2 kali tiap 15 menit, hasil aspirasi ini dibuang.Setelah itu,
dilakukan aspirasi kembali sebanyak 4 kali tiap 15 menit.Bahan aspirasi
ini masing-masing diukur volume dan pH-nya.Nilai BAO adalah volume
tiap spesimen (dalam liter) dikali keasaman (dalam mEq/l). Nilai BAO
keempat spesimen dijumlahkan untuk mendapatkan nilai total BAO
dalam 1 jam (mEg/jam).
Interpretasi:
Nilai BAO >5mEq : didapatkan pada penderita tukak duodenum.
b. Maximal Acid Output (MAO)
Merupakan jumlah total sekresi asam lambung dalam waktu
tertentu (misalnya 1 jam) setelah pemberian rangsangan. Stimulan yang
dipakai adalah histamin, betazol (histalog), atau pentagastrin.Seperti
pada penentuan BAO, terlebih dahulu dilakukan aspirasi sebanyak 2 kali
tiap 15 menit.Kemudian disuntikkan bahan stimulan secara
subkutan.Setelah itu, dilakukan aspirasi sebanyak 4 kali tiap 15 menit,
kemudian diukur volume dan keasamannya.
Interpretasi:
1. Nilai 1-20 mEq : terdapat pada orang normal, ulkus peptikum, dan
karsinoma lambung.
2. Nilai 20-35 mEq : terdapat pada tukak duodenum.
3. Nilai 35-60 mEq : terdapat pada tukak duodenum, high
normal secretor, dan sindrom Zollinger-Ellison.
4. Nilai > 60 mEq :terdapat pada sindrom Zollinger-Ellison.
5. 0 mEq : terdapat pada true achlorhydria, gastritis, atau karsinoma
lambung. Pada keadaan achlorhidrya didapatkan anemia
pernisiosa.
Pemeriksaan Deteksi H.pylori
Deteksi H.pylori dapat dilakukan dengan pemeriksaan rapid urease test
dan urea breath test
Rapid urease test
Rapid Urease Test Pengujian Urease Cepat dilakukan berdasarkan
dari fakta bahwa H. pylori adalah organisme yang menghasilkan
urease.Sampel yang diperoleh dari endoskopi ditempatkan di dalam
medium yang mengandung urea. Jika urease ada, urea akan diuraikan
menjadi karbon dioksida dan ammonia, akibatnya terjadi peningkatan
pH medium dan selanjutnya terjadi perubahan warna pada medium.
Urea Breath test
Urea Breath Test Test Napas Urea mengandalkan aktivitas
urease H. pylori untuk mendeteksi keberadaan infeksi aktif. Dalam test
ini, pasien yang diduga mengidap infeksi diberi urea berlabel- 14 C atau
urea berlabel- 13 C. Urea berlabel- 14 C atau 13 C memiliki kelebihan
bersifat nonradioaktif dan karenanya lebih aman untuk anak-anak dan
wanita setelah melahirkan. Jika ada urease, akan menguraikan urea
menjadi ammonia dan karbon dioksida, karbon dioksida diserap dan
akhirnya terekspirasikan di dalam napas, di mana senyawa ini akan
terdeteksi. Urea Breath Test memiliki sensitivitas dan spesifisitas lebih
dari 90 .
Prosedur pemeriksaan dilakukan dengan cara meniupkan udara
pernafasan kedalam kantong udara yang tersedia yang kemudian
dihubungkan ke alat IRIS untuk mengetahui ada tidaknya H.
pylori.Prosedurnya sederhana dan hasilnya cepat dengan waktu ± 30
menit.Non invasif karena tidak ada alat yang dimasukkan kedalam tubuh
dan tanpa efek samping karena hanya menggunakan udara pernafasan.
Diare didefinisikan sebagai peningkatan frekuensi defekasi
disertai bentuk tinja yang cair.Untuk dewasa (di negara Barat), jumlah
tinja > 200 g/hari sudah disebut diare. Diare dibedakan berdasarkan
waktu terjadinya sakit menjadi 3 yaitu:
1. Diare akut ( < 2 minggu)
2. Menetap (persisten) (2-4 minggu)
3. Kronik ( > 4 minggu)
Diare harus dibedakan dari pseudodiare dan inkontinensia
fekal.Pseudodiare adalah meningkatknya frekuensi defekasi namun
volume tinja yang keluar sedikit, sedangkan inkontinensia fekal adalah
keluarnya kotoran dari rectum secara involunter akibat gangguan
neuromuskuler atau anorektal struktural.
VI.2. Patogenesis Diare
VI.2.1. Fungsi Motor Abnormal
Peningkatan motilitas traktus gastrointestinal berperan dalam
terjadinya diare. Selain perubahan motilitas, juga disertai perubahan
cairan intestinal dan elektrolit.
VI.2.2. Perubahan Transpor Cairan dan Elektrolit
Pada diare terjadi penurunan absorbsi. Tiap 24 jam ke dalam
duodenum masuk 8-10 cairan yang mengandung 800 mmol sodium, 700
mmol chlorida, dan 100 mmol kalium. 2 liter dari cairan tersebut berasal
dari makanan sisanya berasal dari sekresi kelenjar saliva, lambung,
pankreas, dan duodenum.
Usus halus secara normal mengabsorbsi hampir seluruh cairan
tersebut sedangkan 1,5 liter sisanya masuk kolon. Kolon akan
mengabsorbsi cairan tersebut dan tersisa 100 ml yang mengandung
sekitar 3 mmol Na, 8 mmol K, 2 mmol Cl. Kapasitas normal absorbsi
kolon orang dewasa adlah 4-5 L/24 jam. Diare menyebabkan terjadinya
penurunan absorbsi cairan di usus halus maupun kolon. Jika terjadi
gangguan mekanisme transpor epitel atau terdapat zat terlarut yang
tidak dapat diabsorbsi dalam lumen usus halus maka kapasitas absorbsi
usus halus menurun 50%. Penurunan ini menyebabkan kelebihan cairan
di kolon sehingga ekskresi cairan melalui tinja mencapai 1000 mL. Bila
gangguan absorbsi terjadi di kolon maka volume tinja hanya sekitar >
200 mL/24 jam.
VI.2.3. Peningkatan Sekresi
Pada diare juga terjadi meningkatan sekresi intestinal. Salah
satu penyebab peningkatan sekresi adalah mediator inflamasi yang
dilepaskan dari sel sistem imun maupun dari sel mesenkim. Mediator ini
memicu kerja enterosit dan mengaktifkan sistem saraf enterik sehingga
terjadi peningkatan sekresi intestinal.
VI.2.4. Patogenesis Diare Osmotik
Bila dalam lumen usus terdapat beberapa zat yang tidak dapat
diabsorbsi maka akan meningkatkan tekanan osmotik sehingga terjadi
sekresi cairan ke dalam lumen usus.
VI.2.5. Patogenesis Diare Sekretorik
Beberapa zat terlarut seperti sodium, kalium, chlorida, dan
bikarbonat tidak mampu diabsorbsi dan bahkan disekresi aktif. Kedua
hal tersebut menentukan banyaknya cairan yang masuk dan keluar
kolon.
Penyebab diare sekretorik dapat eksogen maupun endogen.
Endogen misalnya asam empedu dan asam lemak rantai panjang
sedangkan eksogen contohnya adalah asam lemak rantai panjang
eksogen.
VI.2.6. Patogenesis Diare Inflamasi
Beberapa diare ditandai dengan kerusakan dan kematian
enterosit dengan minimal hingga inflamasi berat. Perlekatan dan invasi
mikroorganisme penyebab diare infeksi merupakan penyebab
terjadinya diare. Setelah kolonisasi, perlekatan, atau invasi epitelial
mikroorganisme atau inflamasi awal dari Inflammatory Bowel Disease
maka akan dilepaskan berbagai sitokin seperti interleukin-1 (IL-1), TNF-
α, dan kemokin seperti IL-8 dari epitel maupun subepitel miofibroblas.
IL-8 merupakan molekul kemotaktik poten yang akan mengaktifkan
fagosit dan menarik fagosit ke dalam lamina propria. Bila substansi
kemotaktik dilepaskan oleh epitel (IL-8) atau mikroorganisme lumenal
(peptida kemotaktik) terdapat dalam konsentrasi yang cukup dalam
lumen usus, maka netrofil akan menuju epitel dan membentuk abses
kript. Pelepasam mediator seperti prostaglandin, leukotriens, plateletactivating factor, dan hidrogen peroksida dari fagosit akan menginduksi
sekresi intestinal dengan mengaktifkan kerja enterosit dan
mengaktifkan saraf enterik.
VI.3. PEMERIKSAAN LABORATORIUM DIARE
Pemeriksaan laboratorium diare bertujuan untuk :
1. Mengetahui penyebab diare
2. Mengetahui status hidrasi dan keseimbangan cairan dan
elektrolit penderita
3. Memantau terapi
4. Mengetahui komplikasi dan prognosis
VI.3.1. Pemeriksaan Tinja Diagnosis
Pemeriksaan tinja meliputi:
1. Pemeriksaan makroskopis tinja meliputi bentuk, warna, bau,
konsistensi, mukus, darah, pus, sisa makanan, dan parasit
2. Pemeriksaan mikroskopis meliputi sisa makanan (karbohidrat,
protein, lemak, dan sayuran), eritrosit, lekosit, amuba, dan telur
cacing
3. Pemeriksaan darah samar
4. Pemeriksaan Mikrobiologi meliputi pewarnaan Gram, biakan,
dan identifikasi dan sensitivitas
5. Pemeriksaan enteropati hilang protein
6. Pemeriksaan Serologi
VI.3.2. Pemeriksaan Darah Diagnosis
1. Pemeriksaan Darah Rutin
2. Tes Fungsi hati, fungsi pankreas (amilase dan lipase)
3. Serologi (serologi Widal)
4. Biakan dan resistensi
VI.3.3. Pemeriksaan Untuk melihat komplikasi
1. Pemeriksaan elektrolit darah
2. Pemeriksaan ureum dan kreatinin serum
3. Pemeriksaan analisa gas darah
VI.4. PROSEDUR PEMERIKSAAN LABORATORIUM
VI.4.1. Pemeriksaan Tinja Rutin Makroskopis
Pemeriksaan makroskopis meliputi pemeriksaan bentuk, warna,
bau, konsistensi, mukus, darah, dan pus. Normalnya bentuk feses adalah
bulat panjang, warnanya kecoklatan atau coklat muda, berbau indol,
skatol, atau asam butirat, konsistensi lunak, tidak terdapat mukus,
darah, dan pus. Pada keadaan inflamasi dinding intestinal dapat
dijumpai mukus dan darah. Bila terdapat ulserasi intestinal maka selain
darah, mukus, juga dijumpai pus.
VI.4.2. Pemeriksaan Mikroskopis
Alat dan bahan yang diperlukan untuk pemeriksaan adalah:
1. Kaca obyek
2. NaCl fisiologis
3. Mikroskop
4. Eosin
Cara pemeriksaan:
1. Membuat suspensi feses dengan mencampurkan feses dan NaCl
fisiologis
2. Meneteskan setetes suspensi di atas kaca obyek
3. Meneteskan eosin di atas tetesan suspensi dan dicampur rata
4. Memeriksa di bawah mikroskop dengan pembesaran 40X obyektif
5. Melihat ada tidaknya lekosit, eritrosit, atau amuba
Interpretasi:
Feses normal tidak ditemukan lekosit, eritrosit, maupun amuba
VI.4.3. Pemeriksaan Sisa Makanan
Pemeriksaan Karbohidrat
1. Reagen adalah lugol
2. Feses dibuat suspensi atau langsung
3. diteteskan satu tetes suspensi/feses dan ditambahkan satu tetes
lugol
4. Ditutup dengan kaca penutup dan dilihat dibawah mikroskop
Interpretasi : Karbohidrat akan berwarna biru ungu
Pemeriksaan Lemak
1. Reagen adalah Sudan III
2. Feses dibuat suspensi atau langsung
3. diteteskan satu tetes suspensi/feses dan ditambahkan satu tetes
Sudan III
4. Ditutup dengan kaca penutup dan dilihat dibawah mikroskop
Interpretasi: Lemak berwarna orange bulat
Pemeriksaan Protein
1. Reagen adalah Asam asetat 30%
2. Feses dibuat suspensi atau langsung
3. diteteskan satu tetes suspensi/feses dan ditambahkan satu tetes
asam asetat 30%
4. Ditutup dengan kaca penutup dan dilihat dibawah mikroskop
Interpretasi: Protein
VI.4.4. Pemeriksaan Darah Samar (Hemoocult)
Antibodi poliklonal selektif terhadap hemoglobin manusia dengan
sensitifitas dan spesifitas yang tinggi terdapat pada strip. Antibodi ini
akan direaksikan dengan ekstrak colloidal gold mixture yaitu kompleks
antigen antibodi (hemoglobin manusia dalam tinja dengan antibodi
konjugate monoklonal).
Cara Kerja
1. Tinja dibuat suspensi dengan menambahkan NaCl fisiologis
2. Diambil strip dari Hemocult kemudian dimasukkan dalam suspensi
tinja dan dibiarkan 10 menit
3. Kemudian dilakukan pembacaan hasil
Interpretasi hasil pemeriksaan:
Positif bila terdapat 2 warna merah muda pada strip yaitu di
zona kontrol dan dekat sampel
Negatif bila hanya terdapat 1 warna merah jambu pada strip
yaitu pada zona kontrol
Empedu dibentuk oleh lobus hepatic dan disekresi ke dalam
saluran empedu yang terdiri dari saluran-saluran empedu besar dan
kecil yang bersama dengan saluran limfa serta cabang dari vena porta
dan arteri hepatic terdapat dalam region porta diantara lobus-lobus
hati. Saluran empedu interlobular akan bergabung membentuk duktus
hepatikus kanan dan kiri dan selanjutnya keduanya bergabung
membentuk duktus hepatikus komunis. Duktus hepatikus komunis akan
bergabung dengan duktus sistikus dari kandung empedu membentuk
duktus biliaris komunis selanjutnya akan masuk duodenum melalui
ampula Vater setelah sebelumnya bergabung dengan duktus
pankreatikus.1
Cairan empedu dihasilkan oleh hepatosit dan kandung empedu.
Produksi cairan empedu hepatik perhari sekitar (Total daily basal
secretion) 500-600 mL1
. Asam empedu disintesis hanya di
hepatosit.Sekitar 250-500 mg asam empedu dihasilkan oleh hati dan
hilang melalui feses. Sintesis asam empedu diatur oleh mekanisme
umpan balik negatif.2
Empedu hati merupakan cairan isotonic yang komposisi
elektrolitnya mewakili komposisi elektrolit plasma. Sedangkan
komposisi elektrolit empedu dari kandung empedu berbeda dengan
empedu hati karena sebagian besar adalah anion anorganik, klorida, dan
bikarbonat akan dikeluarkan dengan reabsorbsi melalui epitel kandung
empedu. Komponen mayor empedu berdasarkan beratnya terdiri dari
air (82%), asam-asam empedu (12%), lesitin, dan fosfolipid lain(4%),
serta kolesterol tidak teresterifikasi (0,7%). Kandungan lainnya adalah
bilirubin conjugated, protein (IgA, metabolit hormone, dan proteinprotein yang dimetabolisme oleh hati), elektrolit, mucus, dan obat serta
metabolit lainnya. Sebagian besar substansi yang diambil dan disintesis
oleh hepatosit akan disekresi dalam saluran empedu. Membran
kanalikuler membentuk mikrovili dan berhubungan dengan
mikrofilamen aktin, mikrotubulus, dan element kontraktil lainnya.
Sebelum disekresi dalam saluran, substansi tersebut akan dikonjugasi
dalam hepatosit, sedangkan fosfolipid, sebagian asam-asam empedu
primer, dan beberapa kolesterol disintesis de novo dalam hepatosit.
Mekanisme yang mengatur aliran empedu adalah:1
1. Transport aktif asam empedu dari hepatosit ke dalam saluran
empedu
2. Transport aktif anion-anion organic lain
3. Sekresi kolangioseluler. Sekresi ini dimediase sekretin dan
mekanisme yang membutuhkan cAMP dan menghasilkan sekresi
sodium dan cairan kaya bikarbonat dalam saluran empedu
Asam empedu primer terdiri dari asam kolat dan asam
kenodeoksikolat. Keduanya disintesis dari kolesterol dalam hati,
dikonjugasi dengan glisin atau taurin, dan diekskresi dalam empedu.1
Sintesisnya diatur oleh jumlah asam empedu yang kembali ke dalam
hati melalui sirkulasi enterohepatik. Bakteri akan menyebabkan asam
empedu primer menjadi 7α-dehidroksilasi dan menghasilkan asam
empedu sekunder yaitu asam deoksikolat dan asam litokolat (jumlah
sangat sedikit) di kolon. Asam litokolat sedikit diabsorbsi di kolon
dibandingkan asam deoksikolat. Asam empedu sekunder ini bila
mengalami epimerisasi di hati akan menjadi asam empedu tertier yaitu
asam ursodeoksikolat.1, 2 Konjugasi asam empedu akan mencegah
absorbsi dalam cabang saluran empedu dan usus halus tetapi
menyebabkan absorbsinya di ileum terminal. Sulfasi dan glukuronidasi
(sebagai mekanisme detokifikasi) meningkat pada sirosis dan kolestasis
bila konjugat tersebut berlebihan kadarnya dalam urin dan juga
empedu. Bakteri dapat menghidrolisis garam-garam empedu menjadi
asam empedu dan glisin atau taurin.2
Asam-asam empedu merupakan deterjen yang pada larutan cair
dan pada konsentrasi 2mM membentuk agregat molekuler yang disebut
misel. Kolesterol susah laru dalam air dan kelarutannya dalam empedu
tergantung pada konsentrasi lipid total dan persentase molar relative
dari asam-asam empedu dan lesitin. Ratio normal dari kandungan
empedu akan menyebabkan terbentuknya misel campuran yang mudah
larut sedangkan ratio abnormal menyebabkan terjadinya pengendapan
kristal kolesterol dalam empedu.1
VII.2. FUNGSI EMPEDU DAN ASAM EMPEDU
Empedu berfungsi untuk pencernaan dan absorbsi lipid,
homeostasis kolesterol, dan ekskresi xenobiotik yang larut dalam lipid,
obat-obatan dan logam berat.Asam empedu mempunyai berbagai
macam fungsi untuk hati dan saluran pencernaan. Asam empedu akan
menginduksi aliran empedu dan sekresi lipid biliar (fosfolipid dan
kolesterol). Pembawa yang memediasi transport aktif asam empedu ke
dalam saluran empedu membentuk aliran cairan osmotic dan
merupakan faktor mayor yang mengatur pembentukan dan sekresi
empedu. Proses induksi tersebut mempengaruhi sekresi komponen
mayor empedu yaitu bilirubin, kolesterol, dan fosfolipid.
Kemudian asam empedu berperan dalam absorbsi kolesterol di
intestinal dan vitamin yang larut dalam lemak serta pencernaan asupan
makanan yang mengandung lemak.Asam empedu juga meningkatkan
fungsi absorbsi intestinal dengan cara melarutkan asupan makanan
berlemak dan hasil pencernaannya dalam bentuk misel campuran untuk
memfasilitasi difusinya ke dalam mukosa usus halus.Vitamin yang larut
dalam lemak tidak diabsorbsi bila tidak terdapat misel asam empedu
dan gangguan sekresi atau sirkulasi enterohepatik asam empedu.Hal
tersebut dapat menyebabkan terjadinya defisiensi vitamin terlarut
lemak.
Asam empedu juga berperan dalam memelihara homeostasis
kolesterol. Asupan kolesterol akan ditingkatkan dengan memfasilitasi
absorbsi intestinal empedu dan kolesterol dari makanan, disamping itu
juga meningkatkan eliminasi kolesterol. Asam empedu merupakan hasil
katabolisme kolesterol yang larut dalam air dan jalur utama eliminasi
kolesterol melalui feses.Asam empedu juga meningkatkan sekresi
kolesterol hepatik dalam empedu dengan mengindukasi aliran empedu
dan kolesterol empedu larut sehingga kolesterol dapat berpindah dari
hepatosit menuju lumen intestinal untuk dieliminasi. Selain itu kalsium
juga diikat oleh asam empedu sehingga mencegah terjadinya batu
kalsium di kandung empedu dan pembentukan batu oxalat di ginjal.
VII.3. Batu Empedu (Kolelitiasis)
VII.3.1. Epidemiologi
Prevalensi kolelitiasis cukup sering di negara-negara
Barat.Sedangkan di USA kurang lebih 16-20 juta orang menderita
kolelitiasis dan terjadi sekitar 1 juta kasus baru per-tahun.1 Prevalensi
kolelitiasis meningkat sesuai umur dan lebih sering terjadi pada wanita
dari berbagai usia. Batu empedu diklasifikasikan sebagai batu kolesterol
dan batu pigmen.Jenis batu empedu bervariasi menurut latar budaya
daerah. Batu kolesterol sering ditemukan di negara berkembang dan
terjadi pada batu kandung empedu.Lebih dari 75% batu di negara Barat
merupakan batu kolesterol. Sedangkan di Afrika dan Asia yang
mempunyai prevalensi kolelitiasis rendah, jenis batu yang sering
ditemukan adalah batu pigmen dan terdapat pada saluran empedu.
Peningkatan angka kesakitan terjadi pada abad 20 akibat pengaruh dari
gaya hidup dan faktor makanan.4
Faktor risiko terjadinya batu empedu kolesterol adalah:3
1. Umur, terjadi peningkatan sekresi kolesterol dalam empedu dan
penurunan sintesis asam empedu
2. Jenis kelamin (wanita lebih sering ), pada wanita sering terjadi
peningkatan sekresi kolesterol dalam empedu dan peningkatan
waktu transit usus
3. Obesitas, terjadi hipersekresi kolesterol dalam empedu dan
peningkatan sintesis kolesterol melalui aktivitas HMG-CoA
reduktase
4. Penurunan berat badan, terjadi hipersekresi kolesterol dalam
empedu, penurunan sintesis asam empedu, dan hipomotiliti
kandung empedu
5. Nutrisis parenteral, dapat menyebabkan hipomotilitas kandung
empedu
6. Kehamilan
7. Obat-obatan seperti estrogen (hipersekresi kolesterol dan
menurunkan sintesis asam empedu), klorfibrat (menurunkan
konsentrasi asam empedu karena penekanan aktivitas 7
hidroksilase dan menurunkan aktivitas acyl-CoA, cholesterol
acyltransferase (ACAT), sehingga meningkatkan sekresi kolesterol
bebas dalam empedu), progesteron (menurunkan aktivitas ACAT,
meningkatkan sekresi kolesterol, dan hipomotiliti kandung
empedu), ceftriakson (pengendapan garam ceftriakson-kalsium
yang tidak larut)
8. Genetik
9. Kelainan pada ileum terminal karena menyebabkan hiposekresi
garam empedu yang disebabkan rendahnya cadangan asam
empedu (bile acid pool)
10. Kadar HDL rendah, menyebabkan peningkatan aktivitas HMGCoA reduktase
11. Peningkatan TG, menyebabkan peningkatan aktivitas HMG-CoA
reduktase
Faktor predisposisi pembentukan batu pigmen: 1
1. Demografi/genetik, orang Asia dan perkotaan lebih rentan
2. Hemolisis kronik
3. Sirosis alkohol
4. Infeksi traktrus biliaris kronik
5. Infestasi parasit
6. Usia
VII.3.2. Patogenesis
Batu empedu dibentuk oleh pemadatan atau pengendapan
kandungan empedu normal atau abnormal. Jenisnya dibedakan menjadi
3 tipe yaitu:1
1. Batu kolesterol
2. Batu campuran
3. Batu pigmen
Sedangkan Horton dan Bilhartz membaginya menjadi batu kolesterol,
batu pigmen hitam, dan pigmen coklat.5
Defek yang berperan dalam pembentukan batu kolesterol adalah :
1. Supersaturasi kolesterol
2. Nukleasi akselerasi
3. Hipomotiliti kandung empedu
VII.3.2.1. Supersaturasi kolesterol
Kolesterol tidak larut dalam air dan memerlukan aktivitas
deterjen garam empedu dan lesitin (fosfolipid polar) untuk dapat larut.
Tingkat saturasi kolesterol dalam kandung empedu sangat penting
dalam pembentukan kristal kolesterol. Hati merupakan organ yang
bertanggungjawab pada homeostasis kolesterol. Sintesis kolesterol oleh
hati dapat melebihi batas maksimal dan kolesterol juga dibuang dari
tubuh oleh hati secara permanen. Kolesterol yang tidak teresterifikasi
akan disekresi ke dalam empedu. Kolesterol juga merupakan prekursor
seluruh asam empedu dan sintesis serta sekresi asam empedu ke dalam
cairan empedu berfungsi untuk mengeliminasi kolesterol dari tubuh.
Bila terjadi perubahan dalam metabolisme kolesterol akan berpengaruh
secara langsung terhadap kecepatan sekresi asam empedu dan
kolesterol dalam empedu sehingga berpotensi terjadinya batu empedu.
Banyaknya esterifikasi kolesterol mempengaruhi litogenisitas
empedu karena obat yang menurunkan esterifikasi kolesterol seperti
progesteron dan klofibrat cenderung meningkatkan sekresi kolesterol.
Kolesterol disimpan oleh hati dalam bentuk ester asam lemak dengan
bantuan enzim acyl-CoA cholesterol acyltransferase hepatik (ACAT).
Walaupun secara kimia bentuk ini inert tetapi seluruh kolesterol ester
berperan untuk pasokan berkesinambungan kolesterol bebas untuk
pembentukan asam empedu dan penyusunan lipoprotein dalam
retikulum endoplasma. Aktivitas ACAT berperan dalam pool kolesterol
bebas. Rendahnya aktivitas ACAT menyebabkan peningkatan pool
kolesterol bebas di hati sehingga menstimulasi sekresi kolesterol dalam
cairan empedu. Bila jumlah kolesterol bebas dalam empedu tidak
seimbang dengan lesitin dan garam-garam empedu maka terjadi
presipitasi kolesterol dan terbentuk kristal kolesterol
.2.2. Faktor Nukleasi dan Antinukleasi
Nukleasi merupakan proses pertama pembentukan batu empedu
kolesterol setelah terjadi supersaturasi kolesterol. Nukleasi adalah
proses kondensasi dan agregasi sehingga memungkinkan kristal
submikroskopik dan partikel amorf terbentuk dari cairan empedu yang
jenuh. Setelah nukleasi, terjadi kristalisasi menghasilkan kristal
kolesterol monohidrat dan selanjutnya membentuk batu empedu
makroskopik. Perkembangan pemeriksaan untuk mengukur besarnya
nukleasi pada cairan empedu natif memungkinkan mengetahui faktor
spesifik yang merubah nukleasi. Pronukleator merupakan substansi
yang mempercepat pertumbuhan kristal monohidrat kolesterol.
Substansi yang merupakan pronukleator antara lain adalah:
1. Glikoprotein mucin
2. IgG dan IgM
3. Aminopeptidase N
4. Haptoglobin
5. 1-glikoprotein asam
Antinukleator antara lain:
a. Apolipoprotein A-I dan A-II
b. Glikoprotein empedu
VII.3.2.3. Hipomolitas Kandung Empedu
Mukosa kandung empedu merupakan salah satu dari tubuh yang
memiliki kemampuan tinggi untuk absorbsi air. Volume dari sisa
empedu dalam kandung empedu menurun 80-90% sebagai hasil dari
transport aktif sodium beserta absorbsi air secara pasif. Kandung
empedu juga diasamkan oleh empedu melalui absorbsi bikarbonat dan
sekresi ion hidrogen. Konsentrasi cairan empedu mempengaruhi
pembentukan vesikel dan cairan empedu menjadi jenuh setelah
berpuasa semalam. Gangguan motilitas kandung empedu menyebabkan
peningkatan volume residual dan volume puasa sehingga meningkatkan
kemungkinan pembentukan batu. Stasis ini juga dapat menyebabkan
pembentukan sludge. Sludge empedu merupakan hasil presipitasi dalam
empedu dan terdiri dari kristal monohidrat kolesterol berukuran besar,
granula bilirubinat kalsium, dan mukus.
3.2.4. Patogenesis Batu Pigmen
Batu pigmen hitam merupakan hasil peningkatan produksi
bilirubin unconjugated yang selanjutnya mengendap sebagai kalsium
bilirubinat. Hal ini berhubungan dengan hemolisis kronik, sirosis, dan
pankreatitis. Batu pigmen hitam tersusun atas bilirubinat kalsium
(primer), kalsium karbonat, dan kalsium fosfat. Sekitar 20% berat batu
hitam merupakan glikoprotein musin. Pembentukannya disebabkan
hipersekresi bilirubin direk (bilirubin konjugat terutama
monoglukuronida) dalam empedu. Hemolisis menyebabkan peningkatan
keluaran bilirubin konjugat hingga 10X lipat. Bilirubin
monohydrogenated unconjugated dibentuk oleh kerja dari
glukuronidase endogen yang bersama dengan kalsium mengendap dan
terjadi supersaturasi. Defek asidifikasi merupakan hasil inflamasi atau
kapasitas bufering asam sialat dan molekul sulfat gel mukus. Efek
bufering memfasilitasi supersaturasi kalsium karbonat dan fosfat
sehingga terjadi presipitasi. Pada pasien batu empedu hitam tidak
terdapat defek motilitas kandung empedu tetapi terdapat hipersekresi
musin sebagai akibat peningkatan kadar bilirubin unconjugated.
VII.3.2.5. Patogenesis Batu Pigmen Coklat
Batu pigmen coklat sering terjadi di tempat dengan prevalensi
infeksi biliar tinggi. Batu ini terjadi di kandung empedu atau dalam
cabang biliaris dan berhubungan dengan kolonisasi empedu oleh
organisme enterik dan adanya kolangitis asenden. Selain itu juga
berhubungan dengan divertikula duodenal dan lebih sering terbentuk di
saluran empedu dibanding tipe batu yang lainnya.5
Komposisinya terdiri dari garam-garam kalsium dari bilirubin
unconjugated dengan kolesterol dalam ju







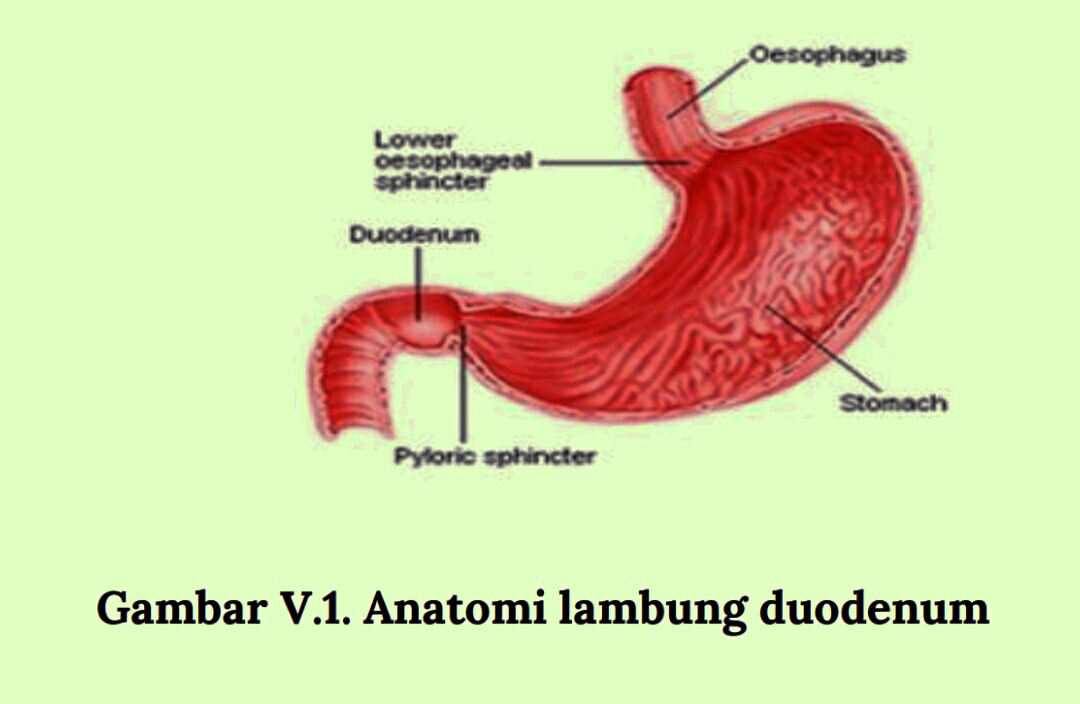














.jpg)







